
- •Iші дәріс тақырыбы
- •1.1 Сапалық анализдің әдістері
- •IIші дәріс тақырыбы
- •IiIші дәріс тақырыбы
- •IVші дәріс тақырыбы
- •Күшті қышқылдан және күшті негізден түзілген тұз -
- •4. Әлсіз қышқылдан және әлсіз негізден түзілген тұз.
- •Vші дәріс тақырыбы
- •VI ші дәріс тақырыбы
- •6.1 Тотығу-тотықсыздандыру (редокс) потенциал
- •6.2 Тотығу-тотықсыздандыру реакцияның тепе-теңдік константасы
- •ViIші дәріс тақырыбы
- •Комплексті қосылыстардағы химиялық байланыстың табиғатың түсіндіретін теориялар
- •Комплексті қосылыстар ерітіндісіндегі тепе-теңдік
- •ViiIші дәріс тақырыбы
- •8.1 Титриметриялық анализдің есептеуі
- •8.2 Қышқылды-негіздік әдісінің титрлеу қисықтары
- •IXші дәріс тақырыбы
- •Хромофорлық теория
- •Xші дәріс тақырыбы
- •Индикаторлар
- •Редокс-индикаторлар
- •XIші дәріс тақырыбы
- •XiIші Дәріс тақырыбы
- •Индикатормен титрлеу әдістері
- •XiiIші Дәріс тақырыбы
- •1. Комплексометрия
- •Цианидометрия
- •Хелатометрия
- •XivДәріс тақырыбы
- •1. Гравиметрия әдіс
- •XV ші дәріс тақырыбы
- •Молекулалы – абсорбциялық анализ
Индикаторлар
Тотығу-тотықсыздандыру әдістерінде екі түрлі индикаторлар қолданылады: арнаулы және тотығу-тотықсыздандыру. Арнаулы индикаторларға крахмал, калий роданиды жатады.
Редокс-индикаторлар
Редокс-индикаторлардың түсі жүйенің потенциалына тәуелді. Тотықтырғыш пен тотықсыздандырғыштың әсерінен редокс индикатордың құрылысында оның түсін өзгертетін өзгерістер жүреді.
Индикатор түсін өзгертетін потенциал аралығы келесі теңдеумен анықталады:
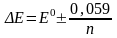 (9.3)
(9.3)
Редокс индикаторлардың ішінде кең тараған: дифениламин, дифениламиносульфоқышқылы және т.б.
Негізгі әдебиет: 1[70-90], 3[28-51], 4[74-87].
XIші дәріс тақырыбы
Тұнбалау әдісі
Тұнбалау титрлеу әдістері тұнбалау реакциясына негізделген. Тұнбалау реакцияның ерекшелігі, реакция нәтижесінде жаңа фаза – тұнба пайда түзіледі. Соның нәтижесінде гетерогенді екі фазалы: ерітінді – тұнба деген жүйе пайда болады. Теңдеу келесі түрде жазылады:
МА ↔ М+ + А-
Бұл жүйеде әрекеттесуші массалар заңы қолданылады: нашар еритін электролиттің қаныққан ерітіндісінде иондар активтіліктерінің көбейтіндісі берілген температурада тұрақты шама.
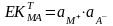
Тұнбалау әдісінде қолданылатың реакцияларға мынадай талаптар қойылады:
а) ерігіштігі 10-5 моль/л < кем болуы керек
б) титрантты қосқан кезде тұнба тез түзілуі қажет
в) қосымша заттар аз түсуі керек
г) реакцияның аяқталуын көрсететін индикатор болуы қажет.
Тұнбалау әдістердің ішінде тәжірибеде ең кең тараған: аргентометрия мен меркурометрия. Аргентометрияның негізгі жұмысшы ерітінділері ретінде күмістың нитраты, натрийдің хлориді және калийдің немесе аммонийдің тиоцианаты алынады. Күміс нитратынің ерітіндісің қарақоныр шыны ыдыста сақтайды, себебі жарыққа күміс тұзы тұрақсыз. Күміс тұзының нақты концентрациясын NaCl ерітіндісі арқылы анықтайды. NaCl және KSCN (немесе NH4SCN) ерітінділерің екі рет кристалданған тұздардан дайындайды. KSCN (немесе NH4SCN) нақты концентрациясы күміс тұзының титрлеген ерітіндісі арқылы анықталады.
Аргентометриялық әдістер галогенидтердің концентрациясын анықтау үшін қолданылады: Ag+ + Cl- = AgCl↓
Ag+ + Г- = AgГ↓
Негізгі әдебиет: 1[189-193], 2[93-95], 3[100-108].
XiIші Дәріс тақырыбы
Тұнбалау әдісінің индикаторлары
Аргентометрияда эквиваленттік нүктені анықтаудың екі жолы бар: индикатормен және индикаторсыз.
Индикаторсыз титрлеу (тең лайлану әдісі)
Бұл әдісті ұсынған Гей-Люссак. Осы әдіс бойынша хлорид-иондарын титрлеген кезде, эквиваленттік нүктеге жақын ерітіндіден екі пробиркаға бірнеше тамшы ерітінді қүйып алады және бірінші пробиркаға AgNO3-ң ерітіндісін, ал екіншісіне NaCl ерітіндісін қосылады. Егер ерітінді эквиваленттік нүктеге жетіп түрса, онда екі ппробиркағады лайлану бірдей болады. Эквиваленттік нүктеге жетпеген ерітінді AgNO3 қосқандағана лайланады, ол эквиваленттік нүктеден асып кеткен ерітінді NaCl қосқандағана лайланады. Лайлану әдісі – жоғары дәлдікпен ерекшеленеді.
Индикатормен титрлеу әдістері
1. Мор әдісі (индикатор ретінде калийдің хроматының 5% ерітіндісі алынады).
Бұл әдіс күміс хроматының (K2CrO4) кірпіш-қызыл тұнбасының эквиваленттік нүктеден кейін пайда болуына негізделген.
2Ag+ + CrO42- = Ag2CrO4↓
Хромат-ионың индикатор ретінде пайдаланғанда титрлеу процесін нейтралды немесе әлсіз негізді ортада өткізеді. Ерітіндінің рН 6,5 төмен, ал 10,5 жоғары болмау керек : 6,5 < pH < 10,5
2. Фольгард әдісі (индикатор – темір (III) тұздары алынады).
Галогенидтерді керісінше титрлеу әдісімен анықтауға пайдаланылады. Бұл әдіс бойынша зерттелетін галогенидтің ерітіндісіне (хлорид немесе бромид) белгілі артық мөлшерінде титрант ретінде AgNO3 ерітіндісі қосылады, содан кейін реакцияға кірмеген Ag+ иондарын екінші титрантпен калий немесе аммоний роданидінің ерітіндісімен анықталады.
n(NaBr) = n(AgNO3) - n(KSCN)
KSCN-ң бірінші артық қосқан тамшысы анық қызыл түс береді. Фольгард әдісімен анықтамаларды қышқыл ортада жүргізуге болады.
Fe3+ + 6SCN- = Fe(SCN)63-
3. Фаянс әдісі (адсорбциялық индикаторлар алынады).
Адсорбциялық индикаторларға тұнбаның бетқабатында адсорбцияланатын көп протонды органикалық қышқылдар жатады.
HnI ↔ nH+ + In-
HnI + nH2O ↔ nH3O+ + In-
Адсорбциялық индикаторларға – флуоресцеин, дихлорфлуоресцеин және эозин жатады.
Негізгі әдебиет: 1[189-193], 2[93-95], 3[100-108].
