
- •Продовження таблиці 1
- •Контрольні питання
- •1.2 Будова атома
- •Контрольні питання
- •Контрольні питання
- •1.4 Хімічна спорідненість
- •Контрольні питання
- •Чи є можливою ця реакція при стандартних умовах?
- •1.5 Хімічна кінетика і рівновага
- •Контрольні питання
- •1 Окислення сірки і її діоксиду протікає за рівняннями:
- •1.6 Способи вираження концентрації розчину
- •Контрольні питання
- •1.7 Іонно-молекулярні (іонні) реакції обміну
- •Контрольні питання
- •1.8 Гідроліз солей
- •Контрольні питання
- •Контрольне завдання № 2
- •2.1 Окисно-відновні реакції
- •Контрольні питання
- •2.2 Електродні потенціали та електрорушійні сили
- •Контрольні питання
- •2.3 Електроліз
- •Контрольні питання
- •2.4 Корозія металів
- •Контрольні питання
- •2.5 Твердість води і методи її усунення
- •Контрольні питання
- •2.6 Органічні сполуки. Полімери Контрольні питання
- •Список літератури
- •Додаток а
1.5 Хімічна кінетика і рівновага
Кінетика
вивчає швидкість різних процесів, в
тому числі хімічних реакцій. Критерієм
принципової здійсненності реакцій є
нерівність ΔG![]() < 0.
Але ця нерівність ще не є повною гарантією
фактичного протікання процесу при даних
умовах, не є достатньою для оцінки
кінетичних
можливостей реакції. Наприклад, G
< 0.
Але ця нерівність ще не є повною гарантією
фактичного протікання процесу при даних
умовах, не є достатньою для оцінки
кінетичних
можливостей реакції. Наприклад, G![]() ,Н2О(г)
= = -228,59 кДж/моль, а G
АlІ
3(к)=-313,8кДж/моль,
звідки, при Т=298 К і Р=1,03·105Па,
можливі реакції
,Н2О(г)
= = -228,59 кДж/моль, а G
АlІ
3(к)=-313,8кДж/моль,
звідки, при Т=298 К і Р=1,03·105Па,
можливі реакції
Н2(г) + 1/2О2(г) = Н2О(г),
2Аl(к) + 3 І2(к) = 2Аl І 3(к).
Але ці реакції при стандартних умовах йдуть тільки у присутності каталізатора (платини для першої і води для другої ). Каталізатор нібито знімає кінетичне “гальмо”, і тоді виявляється термодинамічна природа речовини. Швидкість хімічних реакцій залежить від багатьох факторів, основні з яких – концентрація (тиск) реагентів, температура та дія каталізаторів. Ці фактори обумовлюють і досягнення рівноваги системі, що реагує.
Приклад 1. У скільки разів зміниться швидкість прямої та зворотної реакції системи
2SO2(г) + О2(г) = 2SO3(г),
якщо об’єм газової суміші зменшити в три рази? В який бік буде зміщуватись рівновага системи?
Розв’язання. Позначимо концентрації речовин, що реагують: [SO2]=а, [О2]=в, [SO3]=с. Згідно з законом діючих мас швидкість V прямої та зворотної реакції до зміни об’єму
Vпр.=к·а2·в; Vзвор.=к1·с2.
Після зменшення об’єму гомогенної системи в три рази концентрація кожної з речовин, що реагують, збільшилася в 3 рази: [SO2]=3а, [О2]=3в, [SO3]=3с. При нових концентраціях швидкості V/ прямої і оборотної реакції:
V/пр.= к(3а2)(3в) = 27к а2 в; V/звор.= к1(3с)2 = 9к1 с2.
Звідки
![]() ;
;
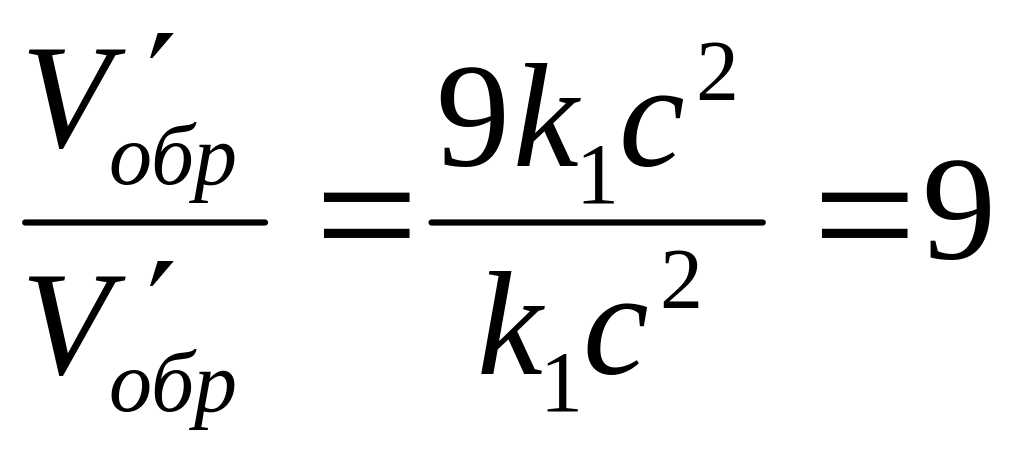 .
.
Отже, швидкість прямої реакції збільшилася в 27 разів, а зворотної - тільки в дев'ять разів. Рівновага системи змістилася у бік утворення SO3.
Приклад 2. Обчислити, у скільки разів збільшиться швидкість реакції, що протікає в газовій фазі, при підвищенні температури від 30 до 70оС, якщо температурний коефіцієнт реакції дорівнює 2.
Розв’язання. Залежність швидкості хімічної реакції від температури визначається емпіричним правилом Вант-Гоффа за формулою
![]() ,
,
![]() .
.
Отже,
швидкість реакції
![]() при температурі 70оС
більше швидкості реакції
при температурі 70оС
більше швидкості реакції
![]() при
температурі 30оС
в 16 разів.
при
температурі 30оС
в 16 разів.
Приклад 3. Константа рівноваги гомогенної системи
СО(г) + Н2О(г) СО2(г) + Н2(г)
при 850°С дорівнює 1. Обчисліть концентрації всіх речовин при рівновазі, якщо вихідні концентрації: [СО]вих =3 моль/л, [Н2О]вих.=2моль/л.
Розв’язання. При рівновазі швидкості прямої і зворотної реакцій рівні, а співвідношення констант цих швидкостей постійне і називається константою рівноваги даної системи:
Vпр.= К1[СО][Н2О] ; Vзвор.= К2[СО2][Н2],
![]() .
.
В умові задачі вказані вихідні концентрації, тоді як у вираз Кр входять тільки рівноважні концентрації усіх речовин системи. Припустимо, що до моменту рівноваги концентрації
[СО2]р = х моль/л. Відповідно до рівняння системи число молей водню, що утворився, при цьому буде також х моль/л. По стільки ж молей (х моль/л) СО і Н2О витрачається для утворення по х молей СО2 і Н2. Отже, рівноважні концентрації всіх чотирьох речовин
[СО2]р= [Н2]р = х моль/л; [СО]р= ( 3 - х) моль/л,
[Н2О]р= (2 - х)моль/л.
Знаючи константу рівноваги, знаходимо значення х, а потім рівноважні концентрації всіх речовин:
![]() ,
,
х2= 6 - 2х - 3х + х2; 5х=6, х = 1,2 моль/л.
Таким чином, рівноважні концентрації:
[СО2]р = 1,2 моль/л,
[H2]p = 1,2 моль/л,
[СО]р = 3 - 1,2 = 1,8 моль/л,
[H2O]p = 2 - 1,2=0,8 моль/л.
Приклад 4. Ендотермічна реакція розкладання пентахлориду фосфору протікає за рівнянням
РСl5(г) РС13(г) + Cl2(г), ΔН = + 92,59 кДж.
Як треба змінити: а) температуру; б) тиск; в) концентрацію, щоб змістити рівновагу у бік прямої реакції - розкладання PCl5?
Розв’язання. Зміщенням чи зсувом хімічної рівноваги називають зміну рівноважних концентрацій речовин, що реагують, у результаті зміни однієї з умов реакції? Напрямок, у якому змістилася рівновага, визначається за принципом Ле-Шателье: а) так як реакція розкладання PCl5 ендотермічна (ΔН > 0), то для зсуву рівноваги у бік прямої реакції потрібно підвищити температуру; б) тому що в даній системі розкладання PCI5 веде до збільшення об’єму (з однієї молекули газу утворяться дві газоподібні молекули), то для зсуву рівноваги убік прямої реакції треба зменшити тиск; в) зсуву рівноваги в зазначеному напрямку можна досягти як збільшенням концентрації РСl5, так і зменшенням концентрації РСl3 чи Cl2.
