
- •Вступ до курсу «електротехнічні матеріали»
- •Зміст та порядок вивчення дисципліни “Електротехнічні матеріали”
- •Блок-схема структури залікового кредиту студентів 2 курсу енергетичного факультету у балах
- •2 Мета, задачі та місце дисципліни «Електротехнічні матеріали»
- •3.1 Загальні відомості
- •3.2 Відомості про будову матеріалів
- •Зонна теорія електропровідності
- •3.4 Природа магнетизму матеріалів
- •3.5 Класифікація етм
- •Запитання для самоконтролю
3.2 Відомості про будову матеріалів
Всі речовини складаються із атомів. Атом – найменша частка хімічного елементу, яка має його властивості. Атом в свою чергу складається із позитивно зарядженого ядра, навколо якого обертаються негативно заряджені електрони. Електрони притягуються до ядра і відштовхуються один від одного.
Зовнішні електрони можуть відриватися від атому та приєднуватися до іншого атома, змінюючи при цьому кількість його зовнішніх електронів. Такі електрони називаються валентними.
Атом, який втратив один або декілька електронів стає позитивно зарядженим. Атом, який приєднав до себе вільні електрони стає негативно зарядженим. Утворені таким чином частки називаються позитивними та негативними іонами (катіонами та аніонами).
Із атомів будуються молекули. Молекула – це найменша частка речовини, яка зберігає її хімічні властивості. До складу молекули може входити від двох до декількох тисяч атомів.
Зв’язки, завдяки яким відбувається об’єднання атомів називаються хімічними, вони підрозділяються на ковалентні, іонні, молекулярні та металічні.
Ковалентні (атомні) зв’язки виникають між атомами за рахунок утворення між ними стійких пар валентних електронів.
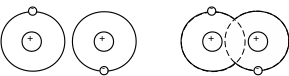
а б
Рисунок 1.1 – Ковалентний (атомний) зв’язок в молекулі водню:
а – ізольовані атоми; б – молекула із ковалентним зв’язком
Речовини із ковалентними зв’язками характеризуються твердістю, крихкістю, тугоплавкістю та хімічною інертністю. До них відносяться кристали германію, кремнію, алмазу, водень, кисень, азот, поліетилен, арсеніди галію та ін.
Іонні зв’язки обумовлені силами електростатичного тяжіння між позитивними та негативними іонами.
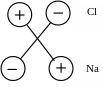
Рисунок 1.2 – Елементарна частка іонного кристалу NaCl
Речовини із іонними зв’язками мають меншу механічну міцність та хімічну стійкість в порівнянні із речовинами із ковалентними зв’язками. До них відносяться неорганічні діелектрики, більшість солей, деякі оксиди (ZnO, CdO, NiO та ін.).
Молекулярні зв’язки утворюються між окремими молекулами внаслідок електростатичного тяжіння між зарядами протилежних знаків, які є в молекулах.
До речовин із молекулярними зв’язками відносяться вода, поліетилен, фторопласт та ін. (Рис. 1.3).

а б
Рисунок 1.3 – Схеми молекул: а – поліетилену ; б – полівінілхлориду
Металічні зв’язки утворюються в металах і обумовлені особливостями поведінки зовнішніх (валентних) електронів. Атоми металів мають здатність віддавати валентні електрони, перетворюючись при цьому в позитивний іон, або приєднувати їх знову, перетворюючись в нейтральний атом.
Метал представляє собою систему, що складається із позитивних іонів, які знаходяться в середовищі колективізованих електронів.
Метали виділяються монолітністю, пластичністю та значною міцністю. Завдяки наявності великої кількості вільних електронів вони мають високу електропровідність.
Речовини із упорядкованим закономірним розташуванням атомів або молекул називаються кристалічними, а речовини із хаотичним розташуванням атомів або молекул – аморфними.
Нанокристалічними матеріалами називають матеріали із розміром кристалів (зерен) менше 100 нм. Такі матеріали значно відрізняються за властивостями від матеріалів із дрібнозернистою структурою (розмір зерен – не більше 5…10 мкм) такого ж хімічного складу.
