
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление
Примеры составления условий задач и их решения
1150
Для организма перманганаты являются ядами. Для лечения острых отравлений перманганатом используются 3% водный раствор H2O2, подкисленный уксусной кислотой. Обезвреживание происходит следующим образом:
KMnO4 + H2O2 + CH3COOH → Mn(CH3COO)2 + CH3COOK + H2O + O2
Определите окислитель и восстановитель в данной реакции. Расставьте коэффициенты методом окислительно-восстановительных полуреакций.
Решение:
KMnO4+H2O2+ CH3COOH→Mn(CH3COO)2+CH3COOK+H2O+O2
 5
H2O2
– 2e
O2
+ 2H+
5
H2O2
– 2e
O2
+ 2H+
2 MnO4- + 8 H+ + 5e Mn2+ + 4H2O
5H2O2+2MnO4- + 8H+ = 5O2+10H++2Mn2+ + 8H2O
2KMnO4 +5H2O2 + 6CH3COOH = 2Mn(CH3COO)2 + 2CH3COOK + 8H2O+ 5O2
1151
Кислородное дыхание приводит к образованию водород-пероксида H2O2. При его взаимодействии с биоорганическими соединениями клеток образуются радикалы. Под действием радикалов разрушаются важнейшие составные части клеток – мембраны и ДНК. В ходе биологической эволюции природа выработала особый белок – фермент каталазу, которая разрушает водород пероксид.
Представьте действие каталазы (CatFe2+) в виде каталитического цикла из двух последовательных реакций.
Сколько циклов может осуществить 1 молекула каталазы в течение секунды?
Решение:
CatFe2+ + H2O2 CatFe2+ ∙ H2O2
CatFe2+ ∙ H2O2 + H2O CatFe2+ + 2H2O2 + O2
В течение одной секунды каталаза может осуществить до 20000 циклов.
1156
Супероксид-ион O-2 играет важную роль в окислительно-восстановительных процессах внутри живых клеток. Предполагается, что увеличенное по сравнению с нормой содержание этих частиц в ткани может способствовать образованию злокачественных опухолей.
O
СОД
-2 взаимодействует с липидным слоем клеточных мембран и повреждает их. Аэробные клетки могут защитить себя от вредного воздействия супероксид радикала с помощью медсодержащего фермента супероксиддисмутазы СОД. Какую реакцию катализирует фермент?Решение: О2- + О2- + 2Н+ → Н2О2 + О2
1159
По распространенности в природе, применению соединений в медицине и технике и роли в организме железо стоит на первом месте в VIII Б группе.
В биогенных соединениях железо связано в комплекс с органическими лигандами (миоглобин, гемоглобин). Рассмотрите образование октаэдрического комплекса [Fe(CN)6]4- d2sp3 гибридизации по методу валентных связей.
Решение: 3d 4s 4p
F e
…3d64s24p0
.
e
…3d64s24p0
.

Fe2+ …3d64s04p0
Благодаря сильному полю CN- вытесняет одиночные электроны на соседние орбитали.
Освободившиеся две 3d и свободные 4s и три 4p гибридизуются:
F e2+
+ 6 CN-
→ →
e2+
+ 6 CN-
→ →
CN- CN- CN- CN- CN-CN-
→ [Fe(CN)6]4-
[Fe(CN)6]4-
1161
По характеру функционирования и воздействия на оргнизм элемент Cd является токсичнопримесным. Токсичность кадмия связана с его сродством к нуклеиновым кислотам. В результате его присоединения к ДНК нарушается ее функционирование. Ионы кадмия также вступают во взаимодействие с сульфидгидрильными SH группами белков, ферментов, аминокислот.
Покажите схему блокировки сульфгидрильных групп. Каков биологический период полувыведения кадмия из организма? Какие вредные последствия внедрения Cd в организм?
Решение:
а)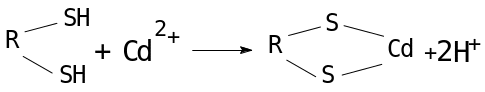
донор акцептор
б) период полувыведения более 10 лет
в) болезнь «итаи-итаи», выражается в болезненном скручивании костей, анемии, почечной недостаточности
1167
Углерод (II) оксид – угарный газ – продукт неполного окисления углерода. Это эндогенный углерод (II) оксид, который образуется в процессах кроветворения. При вдыхании CO с воздухом в легких параллельно с оксигемоглобином образуется металлокомплексное соединение – карбонилгемоглобин. Напишите соответствующие реакции. Почему для детоксикации – устранения отравляющего действия СО достаточно прекратить его поступление и усилить кислородную вентиляцию – вывести пострадавшего на «свежий» влздух.
Объясните с позиции принципа Ле-Шателье.
Решение: HbO2 + CO = HbCO + O2*
Hb + CO = HbCO
Константа устойчивости HbCO ~ в 2500 раз > К уст. HbO2
Повышение в дыхательной среде парциального PO2 будет ускорять диссоциацию HbCO и выделение CO из организма (равновесие смещается влево - образуется HbO2).
1169
Растворимые соединения азота, попадая в воду, могут оказывать токсическое действие. Проникая вместе с пищей в слюну и тонкие кишки, нитраты микробиологически восстанавливаются до нитратов, в результате в крови образуется нитрозил – ионы (NO+).
Нитрозил – ионы могут окислять железо (II) в гемоглобине до железа (III), что препятствует связыванию кислорода гемоглобином. Напишите реакцию образования нитрозил – иона и метгемоглобина. Когда наступает летальный исход?
Решение: NO-2 + H+ = NO+ + OH-
HbFe2+ + NO+ → HbFe3+ + NO
Гемоглобин метгомоглобин
связывает O2 не связывает O2
Возникают симптомы кислородной недостаточности, приводящей к цианозу (синюхе).
При переходе 60-80% железа (II) гемоглобина в железо (III) наступает смерть. Особенно чутко на NO+ реагируют грудные младенцы в первые недели своей жизни. У них недостаточно проявляется деятельность гемоглобинредуктазы, восстанавливающей железо (III) в железа (II).
В задачах (1150 - 1174) определить роль химических элементов и их соединений для организма.
1150
Для организма перманганаты являются ядами. Для лечения острых отравлений перманганатом используются 3% водный раствор H2O2, подкисленный уксусной кислотой. Обезвреживание происходит следующим образом:
KMnO4 + H2O2 + CH3COOH → Mn(CH3COO)2 + CH3COOK + H2O + O2
Определите окислитель и восстановитель в данной реакции. Расставьте коэффициенты методом окислительно-восстановительных полуреакций.
1151
Кислородное дыхание приводит к образованию водород-пероксида H2O2. При его взаимодействии с биоорганическими соединениями клеток образуются радикалы. Под действием радикалов разрушаются важнейшие составные части клеток – мембраны и ДНК. В ходе биологической эволюции природа выработала особый белок – фермент каталазу, которая разрушает водород пероксид.
Представьте действие каталазы (CatFe2+) в виде каталитического цикла из двух последовательных реакций.
Сколько циклов может осуществить 1 молекула каталазы в течение секунды?
1152
Гемоглобин – главная составная часть эритроцитов. Обеспечивает внешнее дыхание, являясь переносчиком кислорода от легких к тканям.
Опишите структуру гемма и образование оксигемоглобина.
Какое дыхание обеспечивают миоглобин, цитохромы, каталаза?
1153
Кобальт является одним из важнейших биогенных элементов. В организме находится в форме цианокобаламина (жирорастворимого витамина B12). Растения и животные не могут синтезировать B12. Его вырабатывают лишь некоторые виды бактерий, которые имеются в желудочно-кишечном тракте чеолвека. Представьте схему данного макроциклического комплексного соединения. К каким заболеваниям приводит дефицит витамина B12?
1154
В медицинской практике находит применение водород-перексид H2O2 . Это соединение является важным побочным продуктом метаболизма. H2O2 может проявлять как свойства окислителя, так и свойства восстановителя (окислительно-восстановительная двойственность).
Определите, какую роль H2O2 играет в реакции
PbO2 + H2O2 + CH3COOH = Pb(CH3COO)2 +O2 + H2O
Расставьте коэффициенты с помощью электронно-ионных полуреакций
1155
Цинк - необходимый элемент всех растений и животных. Ион цинка входит в состав более 40 металлоферментов. Бионеорганический комплекс цинка – фермент карбоангидраза (КА) обеспечивает гидратацию CO2. Напишите реакцию гидратации CO2 в присутствии катализатора КА, которая обусловливает нормальное дыхание.
Во сколько раз замедлялась бы гидратация CO2 в отсутствии карбоангидразы.
1156
Супероксид-ион O-2 играет важную роль в окислительно-восстановительных процессах внутри живых клеток. Предполагается, что увеличенное по сравнению с нормой содержание этих частиц в ткани может способствовать образованию злокачественных опухолей.
O-2 взаимодействует с липидным слоем клеточных мембран и повреждает их. Аэробные клетки могут защитить себя от вредного воздействия супероксид радикала с помощью медсодержащего фермента супероксиддисмутазы СОД. Какую реакцию катализирует фермент?
1157
Цитохромоксидаза (медьсодержащий белок) – один из компонентов дыхательной цепи, локализованной в мембранах митохондрий. Обесцпечивает клеточное дыхание, восстанавливая кислород до воды на конечном участке дыхательной цепи.
При неполном восстановлении кислорода в дыхательной цепи образуются водород водородпероксид и супероксид-анион.
Как осуществляются реакции образования воды, во дород пероксида и супероксид-аниона?
1158
Государственная фармакопея рекомендует для определения подлинности ратсвора водорода пероксида (Hydrogen peroxydatum) использовать реакцию
K2Cr2O7 + H2O2 + H2SO4 = K2SO4 + H2CrO6 + H2O
При этом образуется дипероксохромовая кислота – соединения синего цвета. Синяя окраска и подтверждает подлинность препарата H2O2. Определите окислитель и восстановитель в данной реакции. Расставьте коэффициенты методом окислительно-восстановительных полуреакций. Какова смертельная доза K2Cr2O7 для взрослого человека?
1159
По распространенности в природе, применению соединений в медицине и технике и роли в организме железо стоит на первом месте в VIII Б группе.
В биогенных соединениях железо связано в комплекс с органическими лигандами (миоглобин, гемоглобин). Рассмотрите образование октаэдрического комплекса [Fe(CN)6]4- d2sp3 гибридизации по методу валентных связей.
1160
Известно, что токсические свойства элементов зависят от той химической формы, в какой они попадают в организм. Hg – первый металл, для которого было обнаружено биоконцентрирование. Ртуть микробиологическим путем правращается в метил ртуть, которая через планктон, моллюсков и рыб в конце концов попадает на стол и в пищу.
Укажите, как неорганические соединения ртути превращаются в метил ртуть?
Почему метил ртуть накапливается в организме? Каков период выведения ртути из организма?
1161
По характеру функционирования и воздействия на оргнизм элемент Cd является токсичнопримесным. Токсичность кадмия связана с его сродством к нуклеиновым кислотам. В результате его присоединения к ДНК нарушается ее функционирование. Ионы кадмия также вступают во взаимодействие с сульфидгидрильными SH группами белков, ферментов, аминокислот.
Покажите схему блокировки сульфгидрильных групп. Каков биологический период полувыведения кадмия из организма? Какие вредные последствия внедрения Cd в организм?
Решение:
а)
донор акцептор
б) период полувыведения более 10 лет
в) болезнь «итаи-итаи», выражается в болезненном скручивании костей, анемии, почечной недостаточности.
1162
Многочисленные исследования показали, что цис-изомер дихлородиамминплатины оказывает лечебное действие при раковых заболеваниях. Действие этого комплекса основано на том, что происходит постепенное замещение ионов хилатирующими лигандами. Образуется устойчивый комплекс с молекулой ДНК. Это вещество ингибирует синтез ДНК.
Транс-изомер дихлородиамминплатины (II) токсичен, и противоопухолевым действием не обладает.
Укажите на рис.
изомеры цис-дихлородиамминплатины
(II)
и транс-дихлородиамминплатины (II).
Напишите формулу цис-дихлородиамминплатины (II), указав комплексообразователь, координационное число, степень окисления комплексообразователя.
1163
Соединения платиновых элементов применяют в медицине. Противоопухолевой активностью обладают комплексы, содержащие в качестве лигандов амины- и хлорид ионы; цис-диамминтетрахлорплатина (IV). Комплекс [Ru(NH3)4(OH)Cl]Cl – рутениевый красный применяют для анатомических и гистологических исследований. Его раствор (1:5000) окрашивает в розово-красные тона пектин.
Напишете формулу цис-диамминтетрахлорплатины. Дайте название комплекса [Ru(NH3)4(OH)Cl]Cl, указав комплексообразователь, координационное число, степень окисления комплексообразователя.
1164
В медицинской практике широко применяют буру-кристаллогидрат натрия тетрабората Na2B4O7∙10H2O как антисептик. Фармакологическое действие препарата обусловлено гидролизом соли с выделением борной кислоты. Напишите уравнение гидролиза Na2B4O7. Почему ортоборную кислоту применяют в качестве антисептического средства?
1165
Таллий в соединениях проявляет степень окисления +1. Ион Tl+ склонен образовывать прочные соединения с серосодержащими лигандами:
Tl+ + R-SH → R-S-Te + H+
Вследствие этого он очень токсичен, так как подавляет активность ферментов, содержащих тиогруппы – SH. Даже весьма незначительные количества соединений Tl+ при попадании в организм вызывают выпадение волос.
Находясь в III A группе, для таллия степень окисления +3 менее характерна. Почему? Напишите электронную структуру атома таллия
1166
Углерод диоксид CO2 постоянно образуется в тканях организма в процессе обмена веществ и играет важную роль в регуляции дыхания и кровообращения.
Углерод диоксид растворяется в воде (0,03 моль/л при 298К) при этом образуется угольная кислота: H2O + CO2= H2CO3
Растворы солей угольной кислоты вследствие гидролиза имеют щелочную реакцию. Напишите реакцию гидролиза Na2CO3.
Укажите роль водородкарбонатной буферной системы (Н2СO3-HCO-3) в организме и значение рН крови.
1167
Углерод (II) оксид – угарный газ – продукт неполного окисления углерода. Это эндогенный углерод (II) оксид, который образуется в процессах кроветворения. При вдыхании CO с воздухом в легких параллельно с оксигемоглобином образуется металлокомплексное соединение – карбонилгемоглобин. Напишите соответствующие реакции. Почему для детоксикации – устранения отравляющего действия СО достаточно прекратить его поступление и усилить кислородную вентиляцию – вывести пострадавшего на «свежий» воздух.
Объясните с позиции принципа Ле-Шателье.
1168
Биологическая активность свинца определяется его способностью проникать в организм и накапливается в нем. Свинец и его соединения относится к ядам, действующим на нервно-сосудистую систему и непосредственно на кровь. Ионы Pb2+ являются сильными комплексообразователями. Они образуют прочные комплексы с биолигандами.
Представьте схему блокировки сульфгидрильных групп SH- ионами свинца.
1169
Растворимые соединения азота, попадая в воду, могут оказывать токсическое действие. Проникая вместе с пищей в слюну и тонкие кишки, нитраты микробиологически восстанавливаются до нитратов, в результате в крови образуется нитрозил – ионы (NO+).
Нитрозил – ионы могут окислять железо (II) в гемоглобине до железа (III), что препятствует связыванию кислорода гемоглобином. Напишите реакцию образования нитрозил – иона и метгемоглобина. Когда наступает летальный исход?
1170
При контакте NO2 с влажной поверхностью легких образуются азотистая и азотная кислоты, поражающие легкие, что приводит к отеку и сложным расстройствам. При отравлении нитрозными газами (NO, NO2, N2O3, N2O4) в крови, кроме того, образуется нитраты и нитриты. Нитриты расширяют сосуды и образуют в кислой среде азотистую кислоту, обладающую мутагенным действием. Кроме того, нитриты в кислой среде образуют в желудке вместе с органическими аминами (R1-NH-R2) из растительной и животной пищи нитрозамины, также обладающие мутагенными свойствами.
Напишите реакции, соответствующие описанным процессам.
1171
Мышьяк накапливается в костях и волосах и в течение нескольких лет не выводится из них полностью. Эта особенность используется в судебной экспертизе для выявления вопроса, имело ли место отравление соединениями мышьяка.
К биообъекту добавляют цинк и соляную кислоту. Выделяющийся при реакции водород восстанавливает любое соединение мышьяка до арсина AsH3. При нагревании арсин разлагается 2 AsH3 = 2As + 3H2 и на стенках трубки для газовыделения образуется черный блестящий налет As – «мышьяковое зеркало». Реакция Марша позволяет обнаружить 7∙10-7г мышьяка.
В реакции Марша выделите окислитель, восстановитель, среду и расставьте коэффициенты, используя метод электронно-ионных полуреакций.
As+32O3 + Zn0 + HCl → As-3H3 + ZnCl2 + H2O
1172
Среди оксидов элементов II А-группы в качестве лекарственного препарата применяют MgO. Основные свойства MgO и его нерастворимость в воде обусловливает его применение в качестве антацидного средства при повышенной кислотности желудочного сока. «Магний перекись» (смесь MgO -85% и MgO2 -15%) применяют при желудочно-кишечных расстройствах. Эффект связан с антацидным действием MgO и частично – с бактерицидным действием водород пероксида H2O2, образующегося при растворении препарата в кислом содержимом желудка.
Напишите реакции, соответствующие описанным процессам.
1173
Ионы магния играют важную биологическую роль. Так, например, ион Mg2+ является комплексообразователем в пигменте зеленых растений – хлорофилле. Во внутриклеточной жидкости, для которой характерно высокое содержание ионов Mg2+, аденозинтрифосфат (АТФ) и аденозиндифосфат (АДФ) присутствуют в виде комплексов Mg АТФ2- и Mg АДФ-.
Энергия, необходимая для жизнедеятельности, высвобождается вследствие гидролиза АТФ при обязательном избытке ионов Mg2+.
Напишите реакцию гидролиза АТФ.
