отчеты по лабораторным работам / л.р. №1 определение постоянной ридберга для атомного водорода, 4 сем. / var0 / раздел 4, лаб1
.docОтчёт
ИТМО
Кафедра физики
Студентки:
Группа 2870
Лабораторная работа № 1
Определение постоянной Ридберга для атомного водорода
Цель работы: получение численного значения постоянной Ридберга для атомного водорода из экспериментальных данных и его сравнение с рассчитанной теоретически.
Основные закономерности в излучении атома водорода:
Спектральные линии атомного водорода в своей последовательности обнаруживают простые закономерности.
В 1885 г. Бальмер показал на примере спектра
испускания атомного водорода (рис. 1),
что длины волн четырех линий, лежащих
в видимой части и обозначаемых символами
1885 г. Бальмер показал на примере спектра
испускания атомного водорода (рис. 1),
что длины волн четырех линий, лежащих
в видимой части и обозначаемых символами
![]() ,
,![]() ,
,![]() ,
,![]() ,
можно очень точно представить эмпирической
формулой:
,
можно очень точно представить эмпирической
формулой:
![]() (1)
(1)
где вместо n следует подставить числа 3, 4, 5 и 6; В - эмпирическая константа 364,61нм
Подставив в формулу Бальмера целые числа n=7,8,…, можно получить также и длины волн линий в ультрафиолетовой области спектра.
Закономерность, выраженная формулой Бальмера, становиться особенно наглядной, если представить эту формулу в том виде, в каком ею обычно пользуются в настоящее время. Для этого следует преобразовать ее так, чтобы она позволяла вычислять не длины волн, а частоты или волновые числа.
Известно, что
частота
![]() ,
,
![]() -число
колебаний в 1 с, где с - скорость света в
вакууме;
-число
колебаний в 1 с, где с - скорость света в
вакууме;
![]() -длина
волны в вакууме.
-длина
волны в вакууме.
Волновое число- это число длин волн, укладывающихся в 1м;
![]() ,
,
![]()
В спектроскопии чаще пользуются волновыми числами, так как длины волн определяются в настоящее время с большой точностью, следовательно, с той же точностью известны и волновые числа, тогда же скорость света, а значит и частота, определены со значительно меньшей точностью. Из формулы 1 можно получить:
![]() (2);
(2);
обозначив 4/В через R, перепишем формулу (2):
![]() (3)
где n=3,4,5…
(3)
где n=3,4,5…
У равнение
3 представляет собой формулу Бальмера
в обычном виде. Выражение 3 показывает,
что по мере увеличения n
разность между волновыми числами
соседних линий уменьшается и при
равнение
3 представляет собой формулу Бальмера
в обычном виде. Выражение 3 показывает,
что по мере увеличения n
разность между волновыми числами
соседних линий уменьшается и при
![]() мы получаем постоянное значение
мы получаем постоянное значение
![]() .
Таким образом, линии должны постепенно
сближаться, стремясь к предельному
положению
.
Таким образом, линии должны постепенно
сближаться, стремясь к предельному
положению
![]() .
На рис 1 теоретическое положение предела
этой совокупности спектральных линий
обозначено символом
.
На рис 1 теоретическое положение предела
этой совокупности спектральных линий
обозначено символом
![]() ,
а сближение линий при движении к нему
явно имеет место. Наблюдение показывает,
что с увеличением номера линии n
закономерно уменьшается ее интенсивность.
Если схематически представить расположение
спектральных линий, описываемых формулой
(3), вдоль оси Х и условно изобразить
длиной линий их интенсивность, то
получится картина, показанная на рис.
2. Совокупность спектральных линий,
обнаруживающих в своей последовательности
и в р
,
а сближение линий при движении к нему
явно имеет место. Наблюдение показывает,
что с увеличением номера линии n
закономерно уменьшается ее интенсивность.
Если схематически представить расположение
спектральных линий, описываемых формулой
(3), вдоль оси Х и условно изобразить
длиной линий их интенсивность, то
получится картина, показанная на рис.
2. Совокупность спектральных линий,
обнаруживающих в своей последовательности
и в р аспределении
интенсивности закономерность, схематически
представленную на рис. 2, называется
спектральной серией.
аспределении
интенсивности закономерность, схематически
представленную на рис. 2, называется
спектральной серией.
Предельное волновое число, около которого сгущаются линии при n→∞ называется границей серии. Для серии Бальмера это волновое число ν = 2742000 м-1, и ему соответствует значение длины волны λ0 = 364,61 нм.
Наряду с серией Бальмера в спектре атомного водорода был обнаружен ряд других серий. Все эти серии могут быть представлены общей формулой
ν = R(1/n12 - 1/n22), (4)
где n1 имеет для каждой серии постоянное значение n1 = 1, 2, 3, 4, 5,...; для серии Бальмера n1=2; n2 – ряд целых чисел от (n1+1) до ∞.
Формула (4) называется общей формулой Бальмер. Она выражает собой один из главных законов физики – закон, которому подчиняется процесс излучения атома.
Теория атома водорода и водородоподобных ионов создана Нильсом Бором. В основе теории лежат постулаты Бора, которым подчиняются любые атомные системы.
Согласно первому постулату Бора, атомная систем является устойчивой лишь в определенных (стационарных) состояниях, соответствующих некоторой дискретной последовательности значений энергии Ei системы.
Второй квантовый закон относится к переходам с излучением. Согласно этому закону электромагнитное излучение, связанное с переходом атомной системы из стационарного состояния с энергией Ei в стационарное состояние с энергией ЕL<Ej, является монохроматическим, его частота определяется соотношением
Ej- ЕL=hν, (5)
где h - постоянная Планка.
Дискретные уровни энергии атома водорода определяются известной формулой Бора
Еn = - 2π2me4/h 1/n2 = - hcR 1/n2 (6)
R = 2π2me4/ch3 или R = me4/8 ch3Eo2 (7)
где n – главное квантовое число; m – масса электрона.
Для волновых чисел ν спектральных линий согласно условию частот (5) получается общая формула
ν = Еn2/hc - Еn1/hc = R/n12 - R/n22 = R(1/n12 – 1/n22) (8)
где n1 < n2, а R определяется формулой (7)
При переходах между определенным нижним уровнем (фиксировано) и последовательными верхними уровнями (изменяется от до) получаются спектральные серии атома водорода. В спектре водорода известны следующие серии: серия Лаймана (n1=1 n2≥2); серия Бальмера (n1=2 n2≥3); серия Пашена (n1=3 n2≥4); серия Брекета (n1=4 n2≥5); серия Пфунта (n1=5 n2≥6); серия Хамфри (n1=6 n2≥7).
Формула (8) совпадает с формулой (4), полученной эмпирически, если R – постоянная Рибдерга, связанная с универсальными константами формулой (7).
Описание работы.
Нам известно, что серия Бальмера дается уравнением
ν = R(1/22 – 1/n2),
иначе,
ν = R/4 – R/ n2. (9)
Для определения постоянной Ридберга нужно знать квантовые числа серий Бальмера атомного водорода. Длины волн (волновые числа) линий водорода определяются с помощью монохроматома (спектрометра).
Изучаемый спектр сравнивается с линейным спектром, длины волн которого известны. По спектру известного газа (в денном случае по спектру паров ртути, изображенному на рис.5), можно построить градуировочную кривую монохроматора, по которой затем определяется длина волн излучения атомного водорода.
Приборы и оборудование.
Источник света: водородная газоразрядная трубка, ртутная лампа, ДРШ-2; приборы: "Спектр-1", монохроматор УМ-2.
Порядок выполнения работы
-
Поставить по шкале коллиматора отсчет 9,6
-
зажечь ртутную лампу ДРШ-2
-
установить ширину входной щели монохроматора УМ-2, равную 0,07 мм
-
включить подсветку указателя в окуляре монохроматора
-
уменьшить ширину входной щели до 0,03 мм, просмотреть спектр ртути, сравнив его с рисунком спектра, представленным на установке
-
снять градуировочную кривую монохроматора по спектру ртути
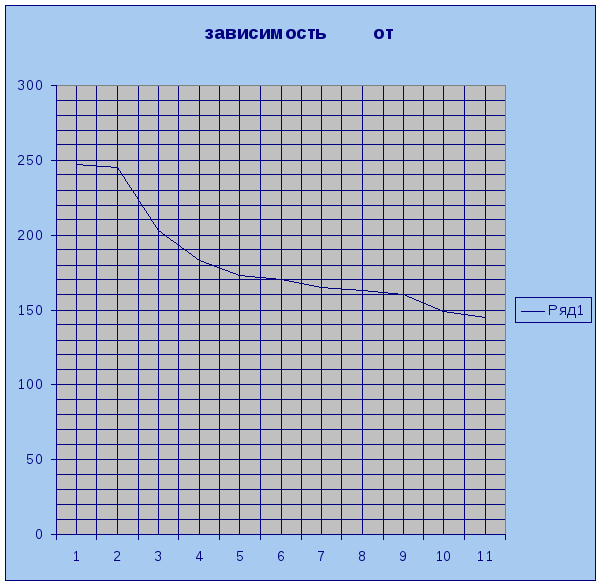
Градуировочная кривая монохроматора – зависит от угла поворота призмы монохроматора от длины волны спектральной линии на выходе. Угол поворота призмы m определяется по барабану с нанесенными на него делениями. Отсчеты по барабану снимаются при совмещении спектральной линии с реперным указателем окуляра монохроматора.
-
Поставить перед монохроматором водородную трубку, снять спектр водорода, т.е. обозначив длины волн водорода
 ,
,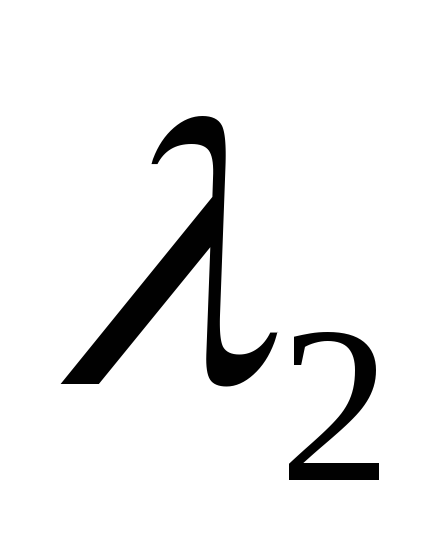 ,
,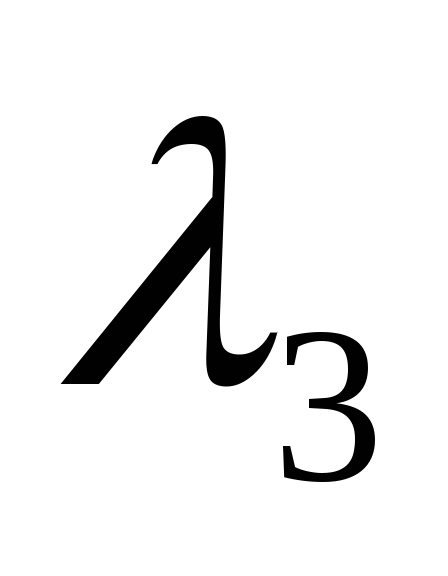 ,
,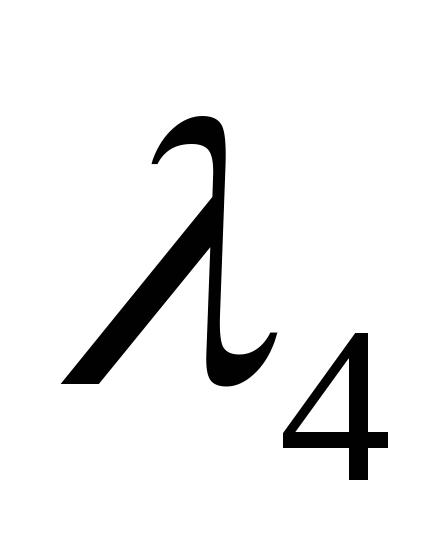 ,
снять отсчет их положения по барабану,
получить соответствующие им значения
углов поворота призмы
,
снять отсчет их положения по барабану,
получить соответствующие им значения
углов поворота призмы
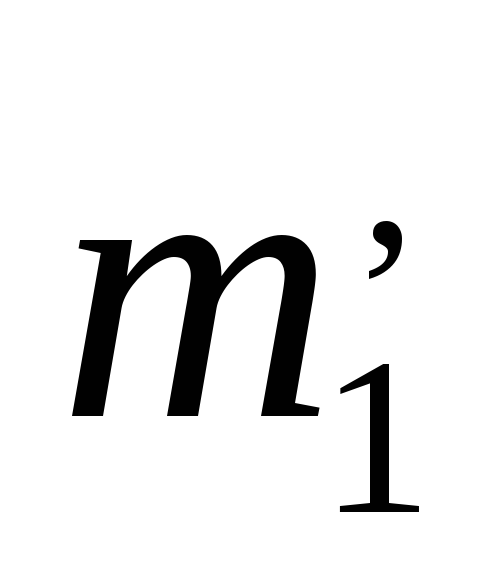 ,
,
 ,
,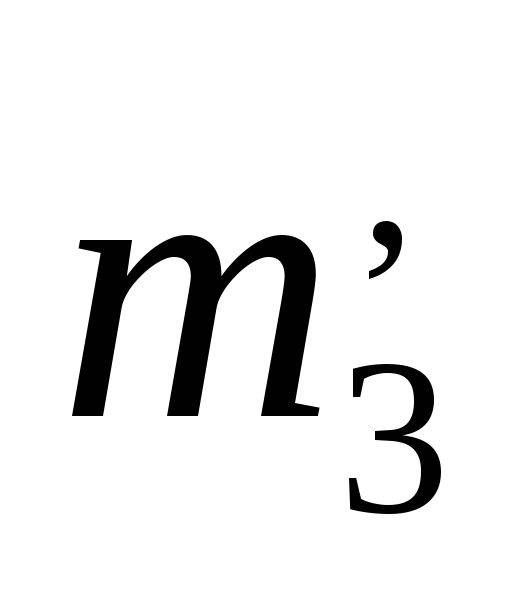 ,
,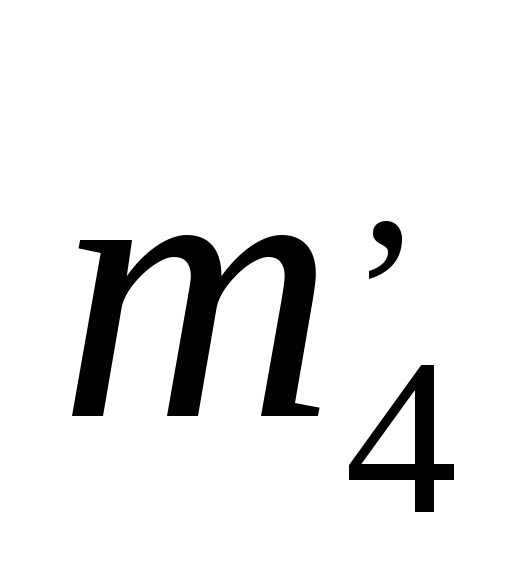
-
построить градуировочную кривую монохроматора
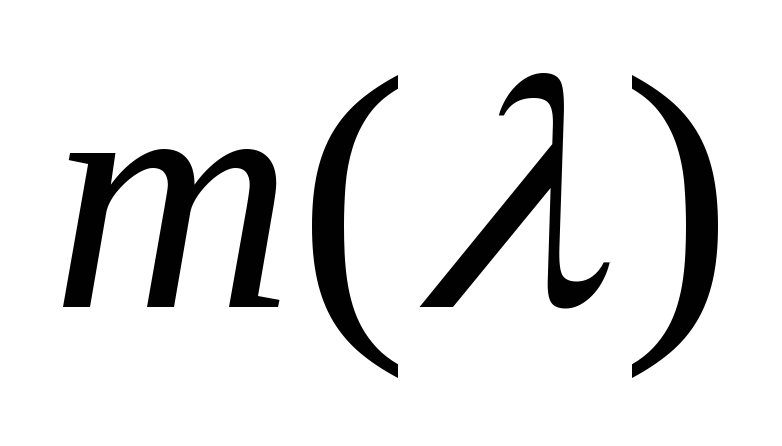 в координатах
в координатах
 и
и
 ,
где
,
где
 -
длины волн линий ртути, m-
соответствующие им углы поворота
призмы, выраженные в делениях барабана
-
длины волн линий ртути, m-
соответствующие им углы поворота
призмы, выраженные в делениях барабана -
По построеной кривой определить линии спектра водорода
-
рассчитать волновые числа для получения длин волн спектра водорода, построить график зависимости
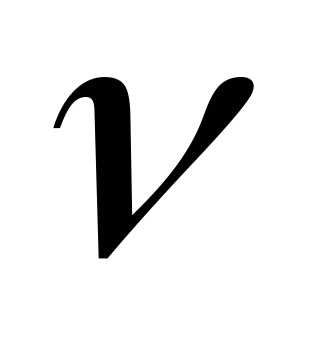 от
от
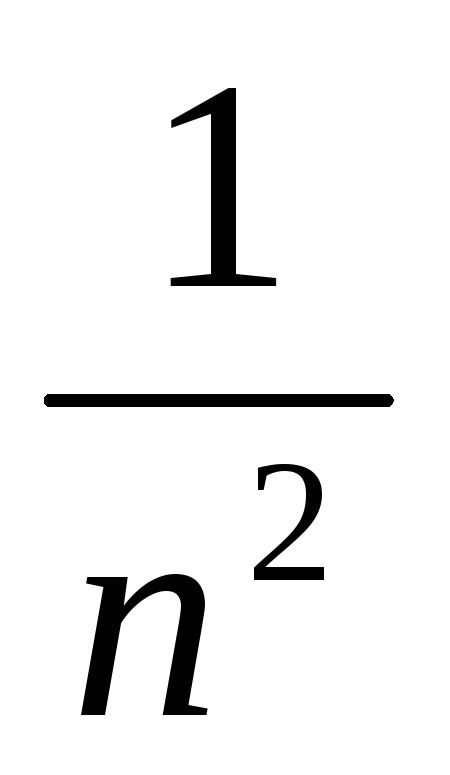 ,
где n соответствующее
главное квантовое число
,
где n соответствующее
главное квантовое число -
найти постоянную Ридберга: 1. по угловому коэффициенту наклона кривой; 2.из графика по значению
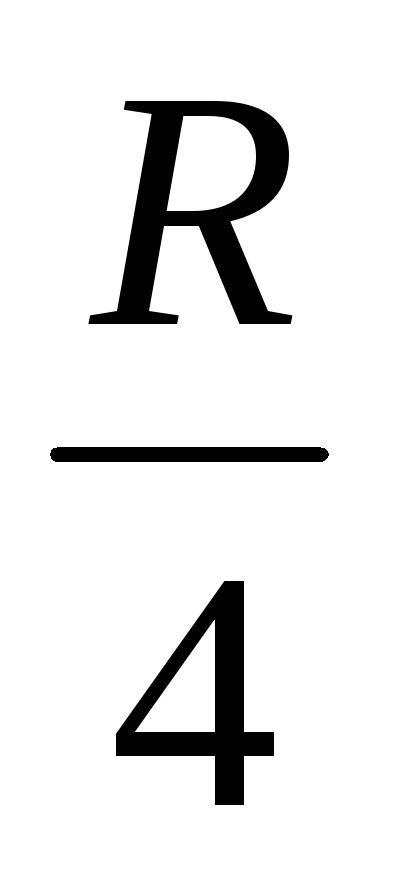 .
Сравнить с теоретическим значением
рассчитанным по формуле (7)
.
Сравнить с теоретическим значением
рассчитанным по формуле (7)
|
Номер п/п |
Цвет волны |
Номер волны |
Длина волны |
Угол поворота |
|
1 |
Красная |
1 |
690,7нм |
3072 |
|
2 |
Красная |
2 |
671,6нм |
2726 |
|
3 |
Красная |
3 |
623,4нм |
2652 |
|
4 |
Красная |
4 |
612,3нм |
2608 |
|
5 |
красная |
5 |
607,2нм |
2560 |
|
6 |
желтая |
1 |
579,0нм |
2496 |
|
7 |
желтая |
2 |
576,9нм |
2484 |
|
8 |
зеленая |
1 |
546,0нм |
2308 |
|
9 |
синяя |
1 |
491,6нм |
1844 |
|
10 |
фиолетовая |
1 |
407,7нм |
1224 |
|
11 |
фиолетовая |
2 |
404,6нм |
658 |
![]()
1.
![]() =1/690,7*
=1/690,7*![]() =0,00145*
=0,00145*![]() =145*
=145*![]() n=12
n=12
2.
![]() =0,00149*
=0,00149*![]() =149*
=149*![]() n=11
n=11
3.
![]() =0,00160*
=0,00160*![]() =160*
=160*![]() n=10
n=10
4.
![]() =0,00163*
=0,00163*![]() =163*
=163*![]() n=10
n=10
5.
![]() =0,00165*
=0,00165*![]() =165*
=165*![]() n=10
n=10
6.
![]() =0,00172*
=0,00172*![]() =172*
=172*![]() n=9
n=9
7.
![]() =0,00173*
=0,00173*![]() =173*
=173*![]() n=9
n=9
8.
![]() =0,00183*
=0,00183*![]() =183*
=183*![]() n=8
n=8
9.
![]() =0,00203*
=0,00203*![]() =203*
=203*![]() n=7
n=7
10![]() =0,00245*
=0,00245*![]() =245*
=245*![]() n= 5
n= 5
11.
![]() =0,00247*
=0,00247*![]() =247*
=247*![]() n=4
n=4
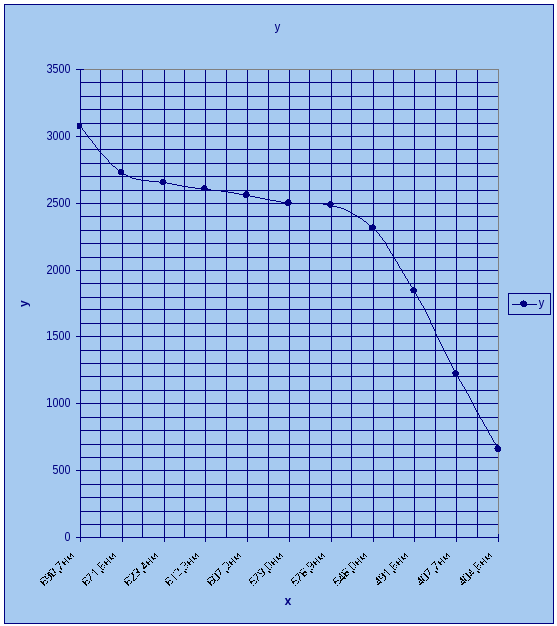 график
зависимости длины волны от угла поворота
призмы
график
зависимости длины волны от угла поворота
призмы