
2.03.2001
В начале 20-го века логика развития физики подошла к микро миру, частицам.
Первая модель атома – 1902 год, модель связана с именем физика Томпсона, который представляет собой «пудинг», т.е. вкрапление частичек в некоторую оболочку. При этом побход был чисто классический. О первой модели мы говорим в качестве исторической рестопрективе, при этом можно сделать и некоторые оценки: заряд связан с обьемной плотностью заряда; сила, которая действует на эти частицы, в первом приюлижении может быть представненна из закона Кулона, с учетом размеров частиц; может быть определена частота вращения частиц, характеризующих эту модель.
Опыт Резерфорда: есть источник, система диафрагм и система ……………………, источник альфа частиц (ионезированный атом гелия Не). Дальше эти частицы попадают на металл. Если предположить, что металл непроницаем для -частиц, то все они должны были бы отразиться от металла, и двигаться в другую сторону. Если же металл проницаем для -частиц, то металл имеет некоторые пустоты и некоторые локальные уплотнения, то ожидается определенная картинка рассеивания. Такая картинка и была получена, но физическое описание, исходя из классических представлений, есественно сводились к изменения импульса этой частицы, и вектора импульса. И эта самая сила, которая определяла изменение импульса, и определялась из этих соотношений.
Планетарная модель атома. Наиболее устойчивое положение атома отрицательной частицы взаимодействующей с положительной частицей это вращательной движение. Понятно, что если мы разместим две частицы на каком-то расстоянии, то согласно общепринятым кулоновским представлением эти частицы должны взаимодействовать (при разных знаках они должны притягиваться), и понятно, что такая модель не может являться устойчивой. Едиественный случай устойчивости такой системы, когда система находиться во вращении.
Классическая электродинамика: Если электрон будет находиться на более высокой или более низкой орбите, то любой переход должен быть связан с поглащением или излучением энергии. Устойчивое положение – это соответствует закону сохранения энергии. Движение заряда излучение. Спектр атома ………частота и ее «обертоны» (частоты, кратные основным).
Спектральный способ. Один из способов изучения строения атома явяется спектральный способ (оптический). 1908 году был введен комбинационный принцип Ритца: Все многообразие спектральных линий атома, может быть получена путем попарных комбинаций гораздо меньшего числа величин, вызываемых спектральными термами. Частота (волновое число) каждой спектральной линии выражается разностью двух термов, т.е. спектр любого атома, любой молекулы, любой молекулярной системы имеет своего рода индефикационный признак, определяет спектр вещества можно определить само вещество.
Волновое число
![]() ,
где
,
где
![]() термы
(положительные величины и с возрастанием
номера термы уменьшаются) . Если
фиксировать n1 и придавать n2
различные значения, начиная с n2=n1+1,
то получиться система спектральных
линий называемых спектртальной серией.
Савокупность спектральных
серий составляет спектр атомов.
Разность частот волновых чисел 2-х
спектральных линий одной серии дает
частоту волновое число спектральных
линий другой серии того же атома.
Действительно:
термы
(положительные величины и с возрастанием
номера термы уменьшаются) . Если
фиксировать n1 и придавать n2
различные значения, начиная с n2=n1+1,
то получиться система спектральных
линий называемых спектртальной серией.
Савокупность спектральных
серий составляет спектр атомов.
Разность частот волновых чисел 2-х
спектральных линий одной серии дает
частоту волновое число спектральных
линий другой серии того же атома.
Действительно:
![]()
Аналитически
удалость получить выражение для
спектральных термов атома водорода:
![]() n=1,2,3,…;
n=1,2,3,…;
![]() постоянная
Ридберга = 109678,76
постоянная
Ридберга = 109678,76
![]() .
Зная значения этих термов и постоянную
Ридберга можно просчитать значения и
порядок эти величин для атома водорода
(как наиболее простого).
.
Зная значения этих термов и постоянную
Ридберга можно просчитать значения и
порядок эти величин для атома водорода
(как наиболее простого).
При n =
1 :
![]() серия Лаймана (1916) находится в
ультро-фиолетовой области.
серия Лаймана (1916) находится в
ультро-фиолетовой области.
При n =
2 :
![]() серия Бальмера (1885) находится в
видимой области.
серия Бальмера (1885) находится в
видимой области.
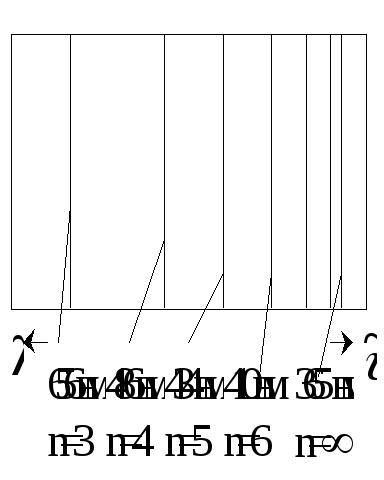
Длина волны растет в направлении в то время как частота в этом направлении уменьшается и наоборот. С возрастанием длины волны уменьшается и номер и наоборот.
При n=3
:
![]() Серия Пашена, находится в инфрокрасной
области. (Предсказана Ритцем в 1908 году).
Серия Пашена, находится в инфрокрасной
области. (Предсказана Ритцем в 1908 году).
Л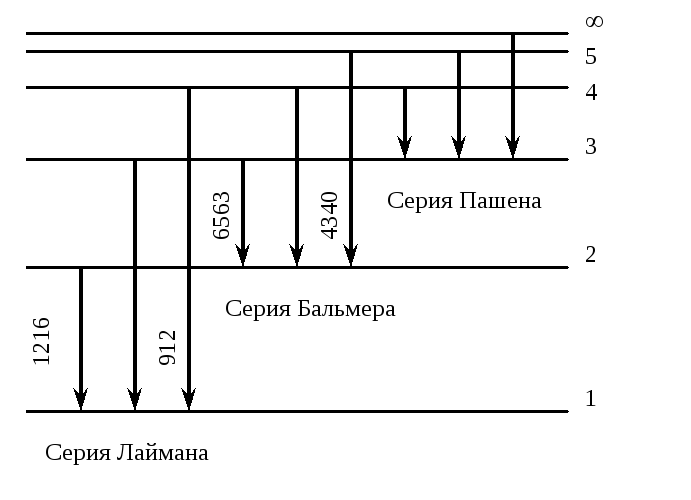 инейчатый
спектр водорода.
инейчатый
спектр водорода.
Линии спектра располагаются не эквидистантно (т.е. не на одинаковом расстоянии). Чем больше номера тем меньше энергия перехода.
![]()
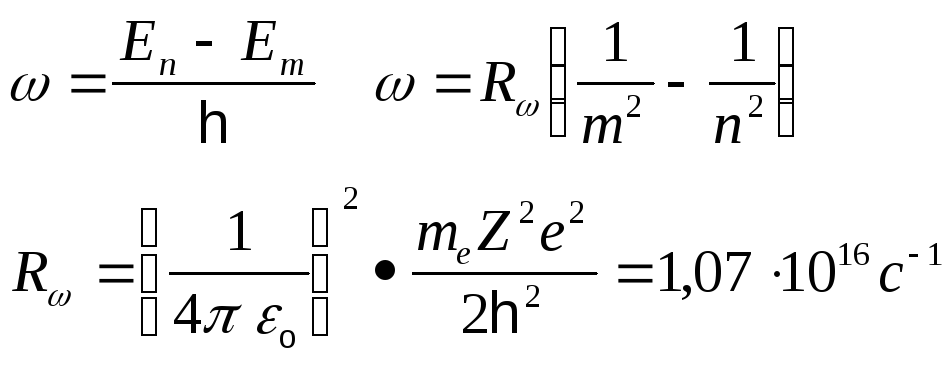
![]() Постояная Ридберга
Постояная Ридберга
Формуле
Бальмера-Ритце :
![]() -
постояная Ридберга.
-
постояная Ридберга.
Постулаты Бора (1913)
Для описания всех вопросов, обсуждаемых нами, итерпритаций спектральных серий или теории спектрального состава или самого излучения как раз и появились те вопросы, тот подход, который привел к создания другого, совершенно другого подхода называемого квантовым.
I. Атом, как и всякая атомная система, может находиться не во всех состояниях, допускаемого классической механникой, а только в некоторых избранных квантовых состояниях, характеризующихся определенными дискретными значениями энергии. Значения этих энергий называются стационарными состояниями, т.к в них (находясь в этих состояниях) атом не иэлучает.
