
- •Системный подход в исследованиях жизнедеятельности человека
- •Механизмы организации живых систем
- •«Болезни цивилизации» и системный подход
- •Психогенные аспекты патологии и системный анализ
- •Реактивность
- •Специфический иммунный ответ
- •Строение иммунной системы
- •Клеточные основы иммунного ответа
- •Гуморальный иммунитет
- •Гипоксия
- •Изменения метаболизма при гипоксии
- •Нарушения работы систем организма
- •Морфологические проявления
- •Приспособительные реакции при гипоксии
- •Химические и лекарственные факторы
- •Избыточное питание
- •Физические факторы
- •Изменение атмосферного давления
- •Действие лучистой энергии
- •Повреждение клетки и межклеточных структур
- •Нарушения межклеточных взаимодействий
- •Повреждение клеточных органелл
- •Дистрофии
- •Белковая дистрофия
- •Гиалиновые изменения
- •Жировая дистрофия миокарда
- •Нарушение обмена нуклеопротеидов
- •Патология водно-электролитного обмена
- •Нефротические отёки
- •Кахексические отёки
- •Нефритические отёки
- •Почечные механизмы
- •Патофизиологические эффекты ацидозов и алкалозов
- •Показатели нарушения кислотно-основного состояния
- •Этиология и патогенез
- •Морфогенез
- •Макроскопические признаки
- •Микроскопические и ультраструктурные признаки
- •Клинико-морфологические формы
- •Апоптоз
- •Этиология и патогенез
- •Морфология
- •Сравнительная характеристика некроза и апоптоза
- •Биохимические отличия апопотоза от некроза
- •Нарушения регуляции апоптоза в патологии и его клиническое значение
- •Свободнорадикальная смерть клеток
- •Смерть клеток при действии ионизирующей радиации
- •Патогенез
- •Местное венозное полнокровие
- •Кровотечение
- •Внутренняя (кровяная) система коагуляции
- •Внешняя (тканевая) система коагуляции
- •Антикоагуляционная система крови
- •Фибринолиз
- •Эндотелий в коагуляции и фибринолизе
- •Тромбоциты
- •Тромбоз
- •Морфология тромба
- •Исходы тромба
- •Патогенез
- •Морфология двс-синдрома
- •Морфология ишемии
- •Инфаркт
- •Воспаление и иммунитет
- •Местные реакции при воспалении
- •Воспаление как общепатологический процесс
- •Гнойное воспаление
- •Продуктивное воспаление
- •Хроническое экссудативное воспаление
- •Воспаление вокруг паразитов и инородных тел
- •Патогенез
- •Стадии развития
- •Классификация
- •Изменения в органах и системах
- •Тепловой и солнечный удары
- •Гипотермия
- •Динамика заживления ран
- •Стадия резистентности
- •Стадия истощения
- •Механизм увеличения функционирующих структур
- •Механизм преобразования структур
- •Реакции гиперчувствительности типа II
- •Аутоиммунные болезни
- •Системные аутоиммунные заболевания
- •Органоспецифические аутоиммунные заболевания
- •Диссеминированные аутоиммунные заболевания
- •Иммунодефициты клеточного происхождения
- •Иммунодефициты гуморального происхождения
- •Амилоидоз
- •Эпидемиология опухолей
- •Этиология опухолей
- •Инфекционная теория канцерогенеза
- •Клеточные онкогены — промоторы опухолевого роста
- •Гены — супрессоры рака
- •Биохимический атипизм
- •Антигенный атипизм
- •Теории опухолевой трансформации
- •Предопухолевая дисплазия
- •Стадия инвазивной опухоли
- •Метастазирование
- •Строма опухоли
- •Ангиогенез в опухоли
- •Характер роста опухоли
- •Взаимодействие опухоли и организма
- •Классификация опухолей
- •Опухоли из эпителия
- •Нейроэндокринные опухоли
- •Опухоли мягких тканей
- •Опухоли меланинпродуцирующей ткани
- •Этиология
- •Диагноз
- •Расхождение диагнозов
- •Ятрогении
- •Патоморфоз
- •Дифференцировка клеток костного мозга
- •Патология эритроцитов
- •Эритроцитозы
- •Классификация анемий
- •Анемии при кровопотерях
- •Дисэритропоэтические анемии
- •Патология лейкоцитов
- •Лейкемоидные реакции
- •Гемобластозы
- •Новообразования миелоидной ткани
- •Острые миелоидные лейкозы
- •Миелодиспластические (миелопролиферативные) заболевания
- •Миелодиспластические синдромы
- •Новообразования лимфоидной ткани
- •Международная классификация новообразований лимфоидной ткани
- •III. Болезнь Ходжкина.
- •Острые лимфобластные лейкозы
- •Хронический лимфоцитарный лейкоз
- •Опухоли из плазматических клеток
- •Болезнь ходжкина
- •Лимфомы кожи
- •Опухоли из гистиоцитов
- •Опухоли из тучных клеток
- •Тромбоцитарные заболевания. Коагулопатии
- •Нарушения сосудистых факторов свёртывания
- •Нарушения плазменных факторов свёртывания
- •Гемофилия
- •Болезнь виллебранда
- •Нарушения тромбоцитарных факторов свёртывания
- •Атеросклероз
- •Гиперлипидемии
- •Патогенез атеросклероза
- •Основные этапы патогенеза атеросклероза
- •Доброкачественная гипертоническая болезнь
- •Заболевания сердца
- •Аритмии
- •Нарушения автоматизма
- •Нарушения проводимости
- •Нарушения возбудимости
- •Смешанные формы аритмий
- •Формы ибс
- •Инфаркт миокарда
- •Хроническая ишемическая болезнь сердца
- •Кардиомиопатии
- •Первичные кардиомиопатии
- •Вторичные кардиомиопатии
- •Миокардиты
- •Перикардиты
- •Сердечная недостаточность
- •Острая сердечная недостаточность
- •Хроническая сердечная недостаточность
- •Опухоли сердца
- •Приобретённые аневризмы артерий
- •Варикозное расширение вен
- •Обструкция лимфатических сосудов
- •Вторичные васкулиты
- •Сосудистые опухоли промежуточной группы
- •Строение и физиология лёгких
- •Нереспираторные функции лёгких
- •Механизмы защиты бронхолёгочной системы
- •Крупозная пневмония
- •Бронхопневмония
- •Отдельные виды острой интерстициальной пневмонии
- •Абсцесс лёгкого
- •Сосудистая патология лёгких
- •Хронические обструктивные заболевания лёгких
- •Хронический обструктивный бронхит
- •Бронхоэктатическая болезнь
- •Хроническая обструктивная эмфизема лёгких
- •Бронхиальная астма
- •Лёгочные васкулиты
- •Пневмокониозы
- •Дыхательная недостаточность
- •Рак лёгкого
- •Болезни плевры
- •Аномалии языка и слизистой оболочки рта
- •Аномалии слюнных желёз
- •Аномалии зубов
- •Кисты головы и шеи
- •Пульпит
- •Некариозные поражения твёрдых тканей зуба
- •Болезни пародонта
- •Гингивит
- •Пародонтит
- •Пародонтоз
- •Хейлиты
- •Глоссит
- •Язвенно-некротический гингивит
- •Кандидозный стоматит
- •Туберкулёз
- •Сифилис
- •Хронический сиаладенит
- •Сухой синдром Шёгрена
- •Опухоли слюнных желёз
- •Кисты челюстей
- •Опухолеподобные поражения челюстей
- •Мезенхимальные одонтогенные доброкачественные опухоли
- •Смешанные одонтогенные доброкачественные опухоли
- •Недостаточность пищеварения
- •Нарушения аппетита
- •Нарушение пищеварения в полости рта
- •Болезни пищевода
- •Дивертикулы пищевода
- •Хиатальная грыжа
- •Эзофагит
- •Врождённые и наследственные аномалии
- •Гастрит
- •Хронический гастрит
- •Опухоли желудка
- •Врождённые аномалии кишечника
- •Синдром мальабсорбции
- •Ишемическая болезнь кишечника
- •Аппендицит
- •Опухоли аппендикса
- •Колоректальный рак (рак толстой кишки)
- •Заболевания брюшины
Гены — супрессоры рака
В геноме обнаружены гены, тормозящие пролиферацию клеток и обладающие антионкогенным действием. Потеря клеткой таких генов может приводить к развитию рака. Наиболее изученные антионкогены — p53 и Rb.
● Ген Rb бывает утрачен при ретинобластоме (частота ретинобластомы — один случай на 20 тыс. детей). 60% ретинобластом развивается спорадически, а 40% относят к наследственным опухолям с аутосомно-доминантным типом наследования. При наследственном дефекте Rb второй аллель нормален, поэтому развитие опухоли возможно только при одновременном повреждении второго (нормального) гена Rb. При спонтанно развившейся ретинобластоме потеря Rb затрагивает сразу оба аллеля (рис. 7-4).
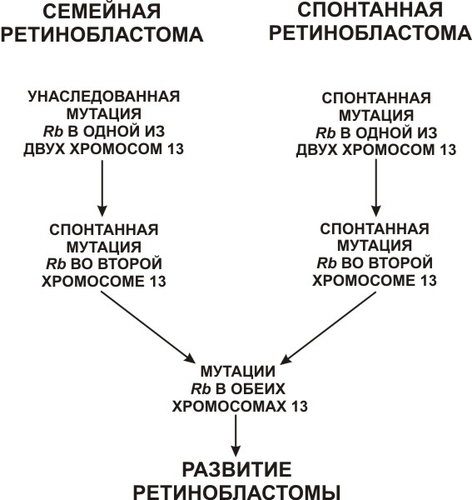
Рис. 7-4. Мутации гена Rb (супрессора рака) при развитии ретинобластомы.
● Ген-супрессор p53 назван молекулой 1995 г. Существуют «дикая» (неизменённая) и мутированная формы антионкогена p53. В опухолевых клетках при многих типах рака обнаруживают накопление одной из этих форм p53 в избыточном количестве, что нарушает регуляцию клеточного цикла и клетка приобретает способность к усиленной пролиферации (рис. 7-5).
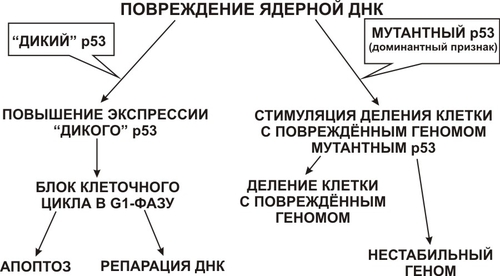
Рис. 7-5. Контроль клеточного цикла геном-супрессором рака p53.
Регуляция пролиферативной активности клетки с помощью p53 происходит через усиление или ослабление им апоптоза. Активация p53 на фоне активации клеточных онкогенов c-fos и c-myc вызывает гибель опухолевых клеток, что наблюдают при действии на опухоль химиопрепаратов и радиации. Мутации p53 или инактивация его другими способами на фоне усиления экспрессии c-fos, c-myc и bcl2, наоборот, приводят к усилению пролиферации клеток и злокачественной трансформации.
ГЕНЫ — РЕГУЛЯТОРЫ АПОПТОЗА
Содержание раздела «Гены — регуляторы апоптоза» смотрите в книге.
ГЕНЫ РЕПАРАЦИИ ДНК
Содержание раздела «Гены репарации ДНК» смотрите в книге.
ОПУХОЛЕВЫЕ МАРКЁРЫ
Традиционные морфологические исследования, как правило, позволяют точно диагностировать дифференцированные опухоли и их метастазы. При низкодифференцированных и недифференцированных злокачественных опухолях используют методы исследования, позволяющие диагностировать изменения на ультраструктурном и молекулярно-генетическом уровнях. С этой целью применяют различные молекулярно-биологические и морфологические методы (ПЦР, гибридизацию in situ, блот- и цитогенетический анализ, иммуногистохимические методы, электронную микроскопию), позволяющие выявлять биомолекулярные маркёры опухолей.
Маркёры опухолей — хромосомные, генные и эпигеномные перестройки в опухолевых клетках, позволяющие диагностировать опухоли, определять степень риска, прогнозировать течение и исходы заболевания. Биомолекулярные маркёры опухолей — более узкое понятие, объединяющее маркёры только белковой природы.
Среди биомолекулярных маркёров выделяют маркёры клеточной дифференцировки (гисто- и цитогенетические) и маркёры прогрессии опухоли (пролиферации, апоптоза, инвазивного роста и метастазирования).
● Маркёры клеточной дифференцировки. Клетки различных типов имеют разный набор дифференцировочных антигенов, или иммунологический фенотип. Экспрессия многих дифференцировочных антигенов зависит от степени зрелости (дифференцировки) опухолевой клетки. Таким образом, маркёры клеточной дифференцировки позволяют оценить не только гисто- и цитогенез опухоли, но и уровень её дифференцировки, функциональную активность опухолевых клеток. Большинство известных дифференцировочных маркёров принадлежит к структурных белкам (белки цитоскелета), ферментам, продуктам секреции (гормоны, иммуноглобулины, муцины), клеточным поверхностным антигенам, компонентам межклеточного матрикса. Известны также белковые опухолевые маркёры, синтезируемые только эмбриональной тканью (α-фетопротеин) и специфические опухолевые антигены (например, антигены меланомы).
● Маркёры прогрессии опухоли. Маркёры клеточной пролиферации широко используют для диагностики, прогнозирования и выбора лечения опухолей. Существует множество морфологических методов, позволяющих выявлять клетки в различных фазах митотического цикла.
◊ Подсчёт числа митозов при световой микроскопии методом ДНК-цито- и гистофотометрии, а также проточной фотометрии — определение процента клеток в фазе митоза (митотического индекса М).
◊ Использование радиоактивной метки (тимидина, бромоксиуридина) — выявление клеток в фазах S, G2, M.
◊ В последнее время применяют иммуногистохимическое определение антигенов митотического цикла: Ki-67 (OMIM *176 741, антиген пролиферирующих клеток MKI67, определяемый коммерческим моноклональным антителам KIA), PCNA (OMIM *176 740, ядерный антиген пролиферирующих клеток PCNA, он же дополнительный белок d ДНК-полимеразы), p105, CDK-2, cdE. Наибольшим диапазоном обладает PCNA, позволяющий выявлять клетки практически во всех фазах митотического цикла. Напротив, селектин (CD62) метит только неделящиеся клетки.
◊ О возможности апоптоза в опухолевых клетках свидетельствует экспрессия многих маркёров: CD95, рецепторов к ФНО-α, ТФР-β, каспаз, Apaf-1, проапоптозных членов семейства bcl2, цитохрома С, p53. Однако о свершившемся апоптозе можно говорить только при характерной фрагментации ДНК, выявляемой методом метки in situ (TUNEL-тест) участков разрыва ДНК, а также по фрагментации PARP (poli-ADP-ribose polimerase, поли-АДФ-рибоза полимераза) или обнаружению фосфатидилсерина на наружной поверхности клеточной мембраны апоптозных телец (Anexin-тест).
ОСНОВНЫЕ СВОЙСТВА ОПУХОЛЕЙ
Основные свойства опухолей — автономный рост, нарушение митоза и апоптоза, наличие атипизма, способность к прогрессии и метастазированию.
АВТОНОМНЫЙ РОСТ
Содержание раздела «Автономный рост» смотрите в книге.
ПАТОЛОГИЯ МИТОЗА И АПОПТОЗА
Для опухолевой ткани характерна патология митоза, выявляемая гистологически и цитологически, а также при проточной цитофотометрии. Митотический цикл, как и в нормальных клетках, состоит из пяти фаз (G0, G1, S, G2, M). Длительность митотического цикла в опухолевых клетках, как правило, равна или больше, чем в гомологичных зрелых неопухолевых клетках. Однако фракция делящихся клеток в опухолевой ткани значительно выше (около 20% клеток).
Нарушение регуляции митоза и апоптоза в опухолевых клетках вызывает их дисбаланс. Дисбаланс между пролиферацией и спонтанным апоптозом существует в виде недостаточного и незавершённого апоптоза.
● Недостаточный апоптоз (по отношению к уровню пролиферации). Снижение уровня апоптоза способствует выживанию мутированных клеток и развитию опухолей, что наблюдают при мутациях p53 и в гормонально-зависимых карциномах молочной, предстательной железы, яичника. Недостаточный апоптоз «запрещённых» клонов активированных B-лимфоцитов, синтезирующих аутоантитела, может приводить к развитию аутоиммунных болезней.
● Незавершённый апоптоз при отсутствии фагоцитоза апоптозных телец, обнаруженный при раке лёгкого. Незавершённый характер апоптоза (без последующего фагоцитоза апоптозных телец) — проявление его патологии при опухолевом росте. Предполагают, что незавершённый апоптоз при раке лёгкого с последующим аутолизом апоптозных телец может ещё в большей степени стимулировать рост опухоли.
Таким образом, рост опухолевой ткани связан, в основном, с увеличением числа делящихся клеток, дисбалансом между митозом и апоптозом, незавершённым характером апоптоза.
АТИПИЗМ
Термин «атипизм» происходит от греч. atypicus — отклонение от нормы. Также используют понятия анаплазия (возврат к эмбриональному этапу развития) и катаплазия (уподобление эмбриональной ткани). Последний термин более правильный, так как при опухолевом росте возврата к эмбриональной ткани не происходит, хотя многие свойства опухолевой ткани сближают её с эмбриональной. В опухолях выделяют морфологический, биохимический, антигенный и функциональный виды атипизма.
МОРФОЛОГИЧЕСКИЙ АТИПИЗМ
Морфологический атипизм (атипизм структуры опухоли) означает, что ткань опухоли не повторяет строение аналогичной зрелой ткани, и клетки опухоли могут быть не похожи на зрелые клетки того же происхождения. Виды морфологического атипизма: тканевой и клеточный.
● Тканевой атипизм — изменение соотношения между паренхимой и стромой опухоли (чаще преобладание паренхимы), изменение величины и формы тканевых структур с появлением уродливых тканевых образований различной величины.
● Клеточный атипизм — появление полиморфизма клеток (как по форме, так и по величине), укрупнение ядер, имеющих часто изрезанные контуры, увеличение ядерно-цитоплазматического соотношения в пользу ядра, появление крупных ядрышек. В результате патологических митозов видны опухолевые клетки с гиперхромными и гигантскими ядрами, многоядерные клетки, фигуры патологических митозов (рис. 7-6).

Рис. 7-6. Клеточный атипизм. Окраска гематоксилином и эозином (x600).
Злокачественным опухолям присущи оба типа морфологического атипизма. Существует положительная корреляция между степенью их выраженности и злокачественностью опухоли. Доброкачественным опухолям свойственен только тканевой атипизм, поскольку они построены из зрелых, дифференцированных клеточных элементов.
Структурные изменения затрагивают все компоненты опухолевой клетки: ядро, цитоплазму, мембраны, органеллы и цитоскелет. Это называют морфологическим атипизмом опухоли. Клеточный атипизм можно наиболее полно изучить с помощью электронной микроскопии.
● Ядра опухолевых клеток, как правило, увеличены, полиморфны, их контуры изрезаны, структура изменена, имеет неупорядоченно расположенный хроматин с конденсацией его в виде глыбок под кариолеммой. Увеличено относительное количество гетерохроматина, содержащего неактивную ДНК, по сравнению с эухроматином, построенным из активно транскрибируемой ДНК. Уменьшение содержания транскрибируемой ДНК, а следовательно, и активно работающих генов в опухолевой клетке означает, что функционально опухолевая клетка примитивна (характерны, в основном, процессы роста и размножения). Увеличение размеров ядра происходит за счёт нарушения процессов эндоредупликации ДНК, полиплоидии, эндомитозов, удвоения хромосом. В ядрах можно увидеть разнообразные включения: вирусные частицы, внутриядерные тельца, тубулярные структуры, пузырьки, выросты, карманы ядерной мембраны.
◊ Ядрышки также изменены. Увеличены их размеры и количество, возникают «персистирующие» ядрышки, не исчезающие во время митозов, увеличены размеры ядрышкового организатора, где сконцентрирована ядрышковая ДНК, кодирующая рибосомальную ДНК.
◊ Ядерная мембрана опухолевых клеток бедна порами, что затрудняет транспорт между ядром и цитоплазмой.
● Поверхность опухолевых клеток. Отмечают увеличение складчатости, появление микровыростов, пузырьков, иногда микроворсинок различной конфигурации и плотности. В области микроворсинок, вероятно, сконцентрированы рецепторы, способные воспринимать канцерогенные агенты.
● Эндоплазматическая сеть опухолевых клеток имеет разную степень развития.
● Митохондрии. Усиление анаэробного гликолиза вызывает уменьшение количества митохондрий, появление крупных и гигантских митохондрий с нарушенной ориентацией крист. Небольшое количество опухолей имеет высокое содержание митохондрий в цитоплазме (онкоцитомы, зернисто-клеточный почечноклеточный рак).
● Цитоскелет опухолевой клетки. Характерна неупорядоченность расположения его компонентов. Микротрубочки образуют перинуклеарную сеть, а микрофиламенты в виде пучков обычно лежат под цитолеммой. Перестройки цитоскелета нарушают взаимодействие молекул адгезии (например, интегринов и кадгеринов), компонентов межклеточного матрикса. Это меняет межклеточные взаимодействия, обеспечивая процессы инвазивного роста и метастазирования.
