
- •Системный подход в исследованиях жизнедеятельности человека
- •Механизмы организации живых систем
- •«Болезни цивилизации» и системный подход
- •Психогенные аспекты патологии и системный анализ
- •Реактивность
- •Специфический иммунный ответ
- •Строение иммунной системы
- •Клеточные основы иммунного ответа
- •Гуморальный иммунитет
- •Гипоксия
- •Изменения метаболизма при гипоксии
- •Нарушения работы систем организма
- •Морфологические проявления
- •Приспособительные реакции при гипоксии
- •Химические и лекарственные факторы
- •Избыточное питание
- •Физические факторы
- •Изменение атмосферного давления
- •Действие лучистой энергии
- •Повреждение клетки и межклеточных структур
- •Нарушения межклеточных взаимодействий
- •Повреждение клеточных органелл
- •Дистрофии
- •Белковая дистрофия
- •Гиалиновые изменения
- •Жировая дистрофия миокарда
- •Нарушение обмена нуклеопротеидов
- •Патология водно-электролитного обмена
- •Нефротические отёки
- •Кахексические отёки
- •Нефритические отёки
- •Почечные механизмы
- •Патофизиологические эффекты ацидозов и алкалозов
- •Показатели нарушения кислотно-основного состояния
- •Этиология и патогенез
- •Морфогенез
- •Макроскопические признаки
- •Микроскопические и ультраструктурные признаки
- •Клинико-морфологические формы
- •Апоптоз
- •Этиология и патогенез
- •Морфология
- •Сравнительная характеристика некроза и апоптоза
- •Биохимические отличия апопотоза от некроза
- •Нарушения регуляции апоптоза в патологии и его клиническое значение
- •Свободнорадикальная смерть клеток
- •Смерть клеток при действии ионизирующей радиации
- •Патогенез
- •Местное венозное полнокровие
- •Кровотечение
- •Внутренняя (кровяная) система коагуляции
- •Внешняя (тканевая) система коагуляции
- •Антикоагуляционная система крови
- •Фибринолиз
- •Эндотелий в коагуляции и фибринолизе
- •Тромбоциты
- •Тромбоз
- •Морфология тромба
- •Исходы тромба
- •Патогенез
- •Морфология двс-синдрома
- •Морфология ишемии
- •Инфаркт
- •Воспаление и иммунитет
- •Местные реакции при воспалении
- •Воспаление как общепатологический процесс
- •Гнойное воспаление
- •Продуктивное воспаление
- •Хроническое экссудативное воспаление
- •Воспаление вокруг паразитов и инородных тел
- •Патогенез
- •Стадии развития
- •Классификация
- •Изменения в органах и системах
- •Тепловой и солнечный удары
- •Гипотермия
- •Динамика заживления ран
- •Стадия резистентности
- •Стадия истощения
- •Механизм увеличения функционирующих структур
- •Механизм преобразования структур
- •Реакции гиперчувствительности типа II
- •Аутоиммунные болезни
- •Системные аутоиммунные заболевания
- •Органоспецифические аутоиммунные заболевания
- •Диссеминированные аутоиммунные заболевания
- •Иммунодефициты клеточного происхождения
- •Иммунодефициты гуморального происхождения
- •Амилоидоз
- •Эпидемиология опухолей
- •Этиология опухолей
- •Инфекционная теория канцерогенеза
- •Клеточные онкогены — промоторы опухолевого роста
- •Гены — супрессоры рака
- •Биохимический атипизм
- •Антигенный атипизм
- •Теории опухолевой трансформации
- •Предопухолевая дисплазия
- •Стадия инвазивной опухоли
- •Метастазирование
- •Строма опухоли
- •Ангиогенез в опухоли
- •Характер роста опухоли
- •Взаимодействие опухоли и организма
- •Классификация опухолей
- •Опухоли из эпителия
- •Нейроэндокринные опухоли
- •Опухоли мягких тканей
- •Опухоли меланинпродуцирующей ткани
- •Этиология
- •Диагноз
- •Расхождение диагнозов
- •Ятрогении
- •Патоморфоз
- •Дифференцировка клеток костного мозга
- •Патология эритроцитов
- •Эритроцитозы
- •Классификация анемий
- •Анемии при кровопотерях
- •Дисэритропоэтические анемии
- •Патология лейкоцитов
- •Лейкемоидные реакции
- •Гемобластозы
- •Новообразования миелоидной ткани
- •Острые миелоидные лейкозы
- •Миелодиспластические (миелопролиферативные) заболевания
- •Миелодиспластические синдромы
- •Новообразования лимфоидной ткани
- •Международная классификация новообразований лимфоидной ткани
- •III. Болезнь Ходжкина.
- •Острые лимфобластные лейкозы
- •Хронический лимфоцитарный лейкоз
- •Опухоли из плазматических клеток
- •Болезнь ходжкина
- •Лимфомы кожи
- •Опухоли из гистиоцитов
- •Опухоли из тучных клеток
- •Тромбоцитарные заболевания. Коагулопатии
- •Нарушения сосудистых факторов свёртывания
- •Нарушения плазменных факторов свёртывания
- •Гемофилия
- •Болезнь виллебранда
- •Нарушения тромбоцитарных факторов свёртывания
- •Атеросклероз
- •Гиперлипидемии
- •Патогенез атеросклероза
- •Основные этапы патогенеза атеросклероза
- •Доброкачественная гипертоническая болезнь
- •Заболевания сердца
- •Аритмии
- •Нарушения автоматизма
- •Нарушения проводимости
- •Нарушения возбудимости
- •Смешанные формы аритмий
- •Формы ибс
- •Инфаркт миокарда
- •Хроническая ишемическая болезнь сердца
- •Кардиомиопатии
- •Первичные кардиомиопатии
- •Вторичные кардиомиопатии
- •Миокардиты
- •Перикардиты
- •Сердечная недостаточность
- •Острая сердечная недостаточность
- •Хроническая сердечная недостаточность
- •Опухоли сердца
- •Приобретённые аневризмы артерий
- •Варикозное расширение вен
- •Обструкция лимфатических сосудов
- •Вторичные васкулиты
- •Сосудистые опухоли промежуточной группы
- •Строение и физиология лёгких
- •Нереспираторные функции лёгких
- •Механизмы защиты бронхолёгочной системы
- •Крупозная пневмония
- •Бронхопневмония
- •Отдельные виды острой интерстициальной пневмонии
- •Абсцесс лёгкого
- •Сосудистая патология лёгких
- •Хронические обструктивные заболевания лёгких
- •Хронический обструктивный бронхит
- •Бронхоэктатическая болезнь
- •Хроническая обструктивная эмфизема лёгких
- •Бронхиальная астма
- •Лёгочные васкулиты
- •Пневмокониозы
- •Дыхательная недостаточность
- •Рак лёгкого
- •Болезни плевры
- •Аномалии языка и слизистой оболочки рта
- •Аномалии слюнных желёз
- •Аномалии зубов
- •Кисты головы и шеи
- •Пульпит
- •Некариозные поражения твёрдых тканей зуба
- •Болезни пародонта
- •Гингивит
- •Пародонтит
- •Пародонтоз
- •Хейлиты
- •Глоссит
- •Язвенно-некротический гингивит
- •Кандидозный стоматит
- •Туберкулёз
- •Сифилис
- •Хронический сиаладенит
- •Сухой синдром Шёгрена
- •Опухоли слюнных желёз
- •Кисты челюстей
- •Опухолеподобные поражения челюстей
- •Мезенхимальные одонтогенные доброкачественные опухоли
- •Смешанные одонтогенные доброкачественные опухоли
- •Недостаточность пищеварения
- •Нарушения аппетита
- •Нарушение пищеварения в полости рта
- •Болезни пищевода
- •Дивертикулы пищевода
- •Хиатальная грыжа
- •Эзофагит
- •Врождённые и наследственные аномалии
- •Гастрит
- •Хронический гастрит
- •Опухоли желудка
- •Врождённые аномалии кишечника
- •Синдром мальабсорбции
- •Ишемическая болезнь кишечника
- •Аппендицит
- •Опухоли аппендикса
- •Колоректальный рак (рак толстой кишки)
- •Заболевания брюшины
Хронический гастрит
Это широко распространённое заболевание. Полагают, что половина населения земного шара страдает хроническим гастритом.
Этиология. В развитии гастрита основную роль играют экзогенные и эндогенные факторы. Экзогенные факторы: хроническое нарушение режима и ритма питания, воздействие химических, термических, механических агентов, радиации, длительного приёма нестероидных противовоспалительных препаратов, алкоголя. Последний в больших концентрациях подавляет секрецию соляной кислоты, пепсиногена и нарушает защитный барьер слизистой оболочки желудка, что приводит к повышенной обратной диффузии водородных ионов и увеличению потери белка.
Эндогенные факторы: аутоинтоксикация (например, при уремии и хронической сердечно-сосудистой недостаточности), механические причины, включающие обструкцию привратника (например, рубцовую), безоары (пищевые камни) и атонию желудка. Хронический гастрит развивается при амилоидозе, гранулематозных болезнях, после резекции желудка или наложения гастроэнтероанастомоза, когда происходит рефлюкс (заброс) дуоденального содержимого в желудок. Иногда причиной хронического гастрита становится аутоиммунизация, когда у больных обнаруживают аутоантитела к париетальным клеткам и к внутреннему фактору Кастла.
Однако в возникновении большинства случаев хронического гастрита главную роль играет Helicobacter pylori (H. pylori). Открытие H. pylori австралийскими гастроэнтерологами B.J. Mаrshall и R. Warren (1983 г.) совершило переворот в гастроэнтерологии. Сейчас этиологическая роль H. pylori в развитии гастрита признана и зафиксирована в Международной классификации хронического гастрита (Сидней, 1990 г.; Хьюстон, 1994 г.). B.J. Mаrshall и R. Wаrren в 2005 г. были удостоены Нобелевской премии.
Helicobacter pylori — грамотрицательная неспорообразующая S-образная бактерия с пятью подвижными жгутиками на одном конце. Обычно H. pylori располагается в пилорическом отделе желудка под слоем слизи, где pH нейтрально, может с помощью уреазы расщеплять мочевину до аммиака и углекислого газа и нейтрализовывать соляную кислоту. H. pylori вырабатывает супероксиддисмутазу и каталазу, предохраняющие от фагоцитоза, и, кроме того, фосфолипазы А и С. Благодаря спиралевидной форме, жгутикам и фосфолипазам, бактерия преодолевает слой слизи на поверхности эпителия, повреждая то и другое. С помощью лептинов и фактора колонизации происходит адгезия бактерии к эпителиоциту желудка.
Распространение инфекции H. pylori носит глобальный характер. Масштабы колонизации возбудителя впечатляют: в настоящее время заражено H. pylori около трёх миллиардов человек. В странах Западной Европы H. pylori обнаруживают у половины населения старше сорока лет, в Латинской Америке — у 70–90% взрослых, в Азии — 40–80%, в Санкт-Петербурге — 46%, у пострадавших от аварии на Чернобыльской атомной электростанции инфицированность лиц старше 35 лет составляет 95–100%, детей до 7 лет — 50%. Доказано, что в развитых странах инфицирование происходит в детском возрасте (до 7–10 лет) и достигает 20–25%, такой уровень сохраняется и у взрослых. Напротив, в развивающихся странах в популяциях с низким доходом инфицирование H. pylori происходит и в детском, и в подростковом возрасте, достигая у взрослых 50–70%.
Однако большинство инфицированных лиц не болеют гастритом и никогда не заболеют ЯБ. Речь идет о типичном представителе желудочно-кишечной флоры, попадающим в организм фекально-оральным или орально-оральным путем во время эндоскопического исследования, при тесном контакте с домашними животными (кошки, собаки, свиньи) или через нестерильные приборы при стоматологическом обследовании.
Существуют особые патогенные типы возбудителя. Выделены штаммы H. pylori, способные вырабатывать вакуолизирующий цитотоксин и цитотоксин-ассоциированный белок VacА и CagA (I тип), и штаммы, не вырабатывающие ни то, ни другое (II тип). Бактерии I типа имеют гены vacA и cagA и продуцируют вакуолизирующий токсин; бактерии II типа имеют только ген vacA (гена cagA нет), однако соответствующий белок не вырабатывают. Адгезивные свойства микроорганизма неодинаково выражены у различных штаммов H. pylori. Наиболее сильно этот феномен выражен у штаммов I типа. Белок CagA через экспрессию гена и синтез матричной РНК стимулирует секрецию ИЛ-8, по уровню последнего и определяют адгезивные свойства бактерии.
Согласно современным представлениям, H. pylori нарушает нормальные процессы регенерации желудочного эпителия, таким образом, микроорганизм прямо или косвенно отвечает за дисрегенераторные процессы, являющиеся важной составляющей в патогенезе гастрита. H. pylori оказывает влияние и на пролиферацию, и на апоптоз эпителиоцитов слизистой оболочки желудка. Нарушение процессов клеточного обновления в слизистой оболочке желудка лежит в основе морфогенеза атрофии при гастрите.
Существует множество методов выявления H. pylori. «Золотой стандарт» диагностики H. pylori — морфологическое исследование с окраской препаратов по Гимзе. Обычно бактерии располагаются в слизи, покрывающей эпителий, на высоте и по краям валиков, иногда непосредственно около эпителиоцитов. Однако внутрь эпителия они не проникают. В участках тесной близости эпителиальная клетка своей апикальной частью образует своеобразное выпячивание, хорошо видимое на электронной микрофотографии, названное Tytgat C.N.J. «адгезивным пьедесталом». Обычно видны спиралевидные структуры бактерии, хотя она может иметь и кокковую форму.
В гастробиоптатах H. pylori выявляют иммуногистохимически с использованием моноклональных антител против H. pylori. Особое значение придают молекулярной диагностике, особенно ПЦР, позволяющей идентифицировать фрагмент ДНК H. pylori, проводить типирование бактерий по уже известным генам сagA, vacA и недавно открытым новым генам iceA, babА.
Патогенез хронического гастрита. С учётом механизма развития выделено несколько основных форм: гастрит типа А, В и С.
Аутоиммунный гастрит, или гастрит типа А — крайне редкое заболевание, в популяции его находят менее чем у 1%, в структуре хронических гастритов — около 10%. У больных аутоиммунным гастритом в крови и в желудочном соке обнаруживают два типа аутоантител: антитела к липопротеину микроворсинок секреторных канальцев париетальной клетки и антитела к внутреннему фактору, блокирующие его связывание с витамином В12. Антитела к париетальным клеткам направлены против Н+,К+-зависимой АТФазы, катализирующей образование соляной кислоты. Разрушение желёз и атрофия слизистой оболочки приводят к прекращению выработки соляной кислоты (гипо- или ахлоргидрия). При этом также прекращается продукция внутреннего фактора, снижение его продукции нарушает всасывания витамина В12 и ведёт к развитию пернициозной анемии. Гастрит типа А — генетическое заболевание. Оно наследуется по аутосомно-доминантному типу и нередко сочетается с такими аутоиммунными заболеваниями, как тиреоидит Хашимото, сахарный диабет I типа, болезнь Аддисона. Учитывая локализацию париетальных клеток, аутоиммунный гастрит всегда поражает тело желудка (фундальный гастрит). Здесь развиваются диффузные атрофические изменения с элементами воспаления, тогда как антральный отдел остается непоражённым. Снижение секреции соляной кислоты нарушает отрицательную обратную связь париетальных клеток и G-клеток, возникает гиперплазия последних, что ведёт к развитию гастринемии.
Бактериальный гастрит, или гастрит типа В — антральный поверхностный гастрит. Однако со временем процесс поднимается выше, гастрит становится не только антральным, но и фундальным. Причина его развития — инфекция, вызванная H. pylori, основную роль играет штамм возбудителя и наличие вакуолизирующего токсина.
Механизм действия vacA расшифрован. Его мишень —АТФаза v-типа эпителиальных клеток, она присутствует в поздних эндосомах, сливающихся друг с другом после контакта с цитотоксином. АТФаза — протонный насос, создающий после стимуляции цитотоксином кислую среду внутри вакуолей. Вещества, поступающие извне в вакуоли (например, аммиак), теряют способность выхода через мембраны и накапливаются внутри вакуолей. После протонирования они осмотически притягивают воду, вакуоли, увеличиваясь в размерах и количестве, «разбухают», сливаются друг с другом, разрывают клеточную мембрану, и клетка погибает. Вакуолизирующий цитотоксин, помимо повреждения клетки, тормозит клеточную пролиферацию и стимулирует высвобождение пепсиногена. Адгезия H. pylori, как и в случае любой бактериальной инфекции, немедленно вызывает сигнальную трансдукцию и реорганизацию цитоскелета эпителиоцитов, отвечающих на это продукцией цитокинов: ИЛ-8 и некоторых других хемокинов. Эти цитокины вызывают миграцию лейкоцитов из кровеносного русла, в результате развивается активная стадия воспаления. Активированные макрофаги секретируют ИФ-α и ФНО-γ, активирующие рецепторы лимфоидных, эпителиальных и эндотелиальных клеток, что, в свою очередь, привлекает в слизистую оболочку новые клетки, участвующие в иммунных и воспалительных реакциях. Метаболиты активного кислорода нейтрофилов оказывают дополнительное повреждающее действие на эпителиоциты желудка. При этом сам H. pylori, благодаря каталазе и супероксиддисмутазе, недоступен для фагоцитоза, а полиморфно-ядерные лейкоциты, наоборот, часто гибнут. Хронический гастрит — диффузная лимфоплазмоцитарная инфильтрация. При наличии лейкоцитов гастрит становится активным.
Рефлюкс-гастрит, или гастрит типа C развивается при забросе (рефлюксе) дуоденального содержимого в желудок. В двенадцатиперстной кишке, где идет процесс переваривания и всасывания жиров, лецитин под действием поступающих из поджелудочной железы трипсина и фосфолипазы А превращается в лизолецитин. Основной механизм развития гастрита типа С — цитотоксическое действие на слизистую оболочку желудка лизолецитина. При рефлюкс-гастрите H. pylori выявляют редко, не более чем в 15%. случаев, секреция соляной кислоты обычно не нарушена, количество гастрина в пределах нормы. Доля рефлюкс-гастрита в структуре заболеваемости хроническими гастритами незначительна.
Помимо названных выше, в модифицированной Сиднейской Системе выделены особые формы хронического гастрита: лимфоцитарный, радиационный, гранулематозный, эозинофильный, коллагеновый, гипертрофический и др. Патогенез в каждом случае свой, причем не всегда ясный. Терминология не очень удачна, так как часть гастритов названа по морфологическому принципу, часть — по этиологическому.
● Лимфоцитарный (вариолоформный, или хронический эрозивный) гастрит. Характерна инфильтрация лимфоцитами исключительно покровно-ямочного эпителия: примерно 30 лимфоцитов на 100 эпителиоцитов (при хеликобактерном гастрите 7–10 на 100 эпителиоцитов), тогда как в собственной пластинке слизистой оболочки лимфоциты немногочисленны. Эндоскопически при этом на высоте складок видны узелки с изъязвлённой поверхностью. Лимфоцитарный гастрит составляет около 4,5% всех гастритов. Локализация его также отличается от остальных форм: в 76% — пангастрит, 18% — фундальный и только в 6% — антральный (неспецифический гастрит в 91% случаев — антральный). Этиология и патогенез неизвестны. H. pylori выявляют гораздо реже, чем при гастрите типа В, однако антитела к H. pylori обнаруживают почти всегда, в половине случаев в сочетании с целиакией. Скорее всего, лимфоцитарный гастрит — следствие глубоких нарушений иммунной системы слизистых оболочек, а H. pylori — фактор, провоцирующий развитие заболевания.
● Эозинофильный гастрит. Ярко выражена эозинофильная инфильтрация иногда только слизистой оболочки, иногда всех слоёв стенки желудка. Подобные изменения обнаруживают при болезни Крона, паразитарных поражениях желудка, иногда при язве и раке. У 25% больных в анамнезе аллергия, бронхиальная астма, экзема. По течению гастрит может быть острым или хроническим рецидивирующим. Кроме того, эозинофильный гастрит бывает проявлением эозинофильного гастроэнтерита. У больных склеродермией, дерматомиозитом эозинофилии крови нет, эозинофильный инфильтрат сочетается с тучными клетками, особенно выражен в глубоких слоях стенки желудка и завершается массивным фиброзом мышечной пластинки.
● Гранулематозный гастрит. Характерно наличие в слизистой оболочке желудка эпителиоидноклеточных гранулём, нередко с гигантскими многоядерными клетками. Подобные гранулёмы находят при саркоидозе, болезни Крона, туберкулёзе, микозах, отравлении бериллием, инородных телах и др. При саркоидозе антральный гранулематозный гастрит встречается в 10% случаев, при болезни Крона — в 7%. Однако в гастробиоптатах гранулёмы выявляют гораздо реже. Вблизи инородных тел значительно чаще, в 10–29% возникают другие, гигантоклеточные гранулёмы.
● Коллагеновый гастрит отличается отложением коллагена под покровным эпителием желудка в виде тяжей толщиной до 20–30 мкм. В эпителии находят очаговые повреждения и повышенное количество интерэпителиальных лимфоцитов. В кишечнике подобные изменения обозначают как коллагеновая спру и коллагеновый колит. Этиология и патогенез заболевания неизвестны. Предполагают участие иммунных механизмов, нарушающих функцию перикриптальных фибробластов и их обновление.
● Гипертрофическая гастропатия (гипертрофический гастрит) наиболее интересна. Характерна гипертрофия слизистой оболочки желудка и образование гигантских складок, напоминающих клубок змей. В основе подобных изменений лежит не воспаление, как ошибочно полагали раньше, а гиперплазия покровно-ямочного и/или железистого эпителия. Выделено три типа гипертрофической гастропатии: мукозный, гландулярный и смешанный.
Клинически для гипертрофической гастропатии характерны следующие синдромы:
болезнь Менетрие;
синдром Золлингера-Эллисона;
гипертрофическая гиперсекреторная гастропатия с потерей и без потери белка.
Структура заболеваемости хроническим гастритом неоднородна, 90% составляет бактериальный гастрит типа В.
Морфогенез хронического гастрита. Постоянное раздражающее действие на слизистую оболочку желудка различных экзогенных и эндогенных факторов, уреазы H. pylori, лизолецитина жёлчи или аутоантител неизбежно активизирует кислотно-пептические факторы агрессии желудочного сока. Это нарушает, в первую очередь, регенерацию эпителия и проявляется различными вариантами.
Темпы регенерации эпителия возрастают. Прежде всего, укорачивается фаза дифференцировки эпителия: не достигнув степени зрелости, молодые недифференцированные эпителиоциты подвергаются инволюции. Наибольшие изменения происходят в специализированных клетках желёз, что выявляется на электронограммах. Главные клетки содержат единичные зимогенные гранулы с незрелым мукоидом. Цитоплазма их загустевает за счёт слияния мелких гранул, содержащих секрет, близкий по структуре к секрету слизистых клеток. В париетальных клетках видны признаки преждевременной инволюции: редукция крист и просветление матрикса митохондрий, отложение липидов и миелиноподобных структур, обилие крупных вторичных лизосом; тубуловезикулы отсутствуют, хорошо развит лишь аппарат Гольджи и эндоплазматическая сеть.
Незрелые клетки из ямочно-шеечной области (естественной их локализации) устремляются вверх и вниз. Гистоавторадиографический метод позволяет увидеть незрелые ДНК-синтезирующие клетки на вершине валиков и даже в теле желёз. Преобладают добавочные (слизистые) клетки, они начинают занимать в железах отделы, предназначенные для париетальных и главных клеток. Таким образом, транслокация слизистых клеток завершается уменьшением количества специализированных гландулоцитов, вырабатывающих основные ингредиенты желудочного сока — соляную кислоту и пепсиноген. В то же время покровный эпителий с явными признаками недоразвития гораздо дольше остается на валиках, не подвергаясь апоптозу в установленные сроки.
Процесс апоптоза извращён, что особенно характерно для инфекции H. pylori: если в норме около 2–3% клеток желудка находятся в состоянии апоптоза, то при инфекции H. pylori их количество возрастает до 8%, при этом апоптозные тельца выявляют не только на поверхности валиков, но и по всей длине железы.
При хроническом гастрите, наряду с характерным для каждого отдела желудка эпителием, нередко появляется эпителий, не свойственный этому отделу, т.е. происходит структурная перестройка эпителия или метаплазия. Возможны два варианта метаплазии.
● Пилорическая метаплазия в области фундальных желёз, при ней в теле желудка появляются железы, напоминающие слизистые, или пилорические (псевдопилорические железы Штерка).
● Кишечная метаплазия, когда слизистая оболочка желудка внешне напоминает слизистую оболочку кишки с характерными ворсинками вместо валиков, выстланными каёмчатыми энтероцитами, бокаловидными клетками с наличием клеток Панета (полная, или тонкокишечная метаплазия). Иногда эпителиальные клетки напоминают колоноциты, бокаловидных клеток много, а клетки Панета отсутствуют (неполная, или толстокишечная метаплазия). Именно этот эпителий может при определённых условиях малигнизироваться: желудочный эпителий, в норме всасывающий лишь алкоголь, в очагах кишечной метаплазии всасывает липиды. Однако система дренирования отсутствует, и растворимые в липидах канцерогены депонируются в стенке желудка, вызывая переход метаплазии и дисплазии в рак. Выражением крайнего извращения регенерации при хроническом гастрите являются «клетки-химеры», или «клетки-миксты», их характерная особенность — наличие в одной клетке ультраструктурных признаков сразу нескольких высокоспециализированных зрелых клеток. Например, бывают клетки, сочетающие элементы париетальной (внутриклеточные канальцы) и главной (зимогенные гранулы) клеток или главной клетки и покровного эпителия (мукоид).
Основные процессы морфогенеза хронического гастрита — нарушение и извращение регенерации. Они неизбежно заканчиваются атрофией железистого аппарата желудка. Хронический гастрит — прежде всего, дисрегенераторный процесс. Наряду с нарушенной регенерацией, видны воспалительные (инфильтрация собственной пластинки лимфоцитами, плазмоцитами), склеротические (разрастание соединительной ткани) и атрофические изменения (вытеснение участками склероза железистого аппарата желудка).
Классификация хронического гастрита, помимо этиологии и патогенеза заболевания, учитывает топографию процесса, морфологические типы гастрита, активность процесса, наличие и выраженность метаплазии эпителия.
● По топографии различают три варианта хронического гастрита: антральный, фундальный и пангастрит.
● По морфологии выделяют поверхностный (неатрофический) и атрофический гастрит.
◊ Хронический поверхностный гастрит. Слизистая оболочка желудка обычной толщины. Покровный эпителий с дистрофическими изменениями. Собственная пластинка слизистой оболочки инфильтрирована лимфоцитами и плазматическими клетками. Инфильтрат обычно располагается в поверхностных отделах на уровне валиков. В период обострения в инфильтрате и эпителии появляются полиморфно-ядерные лейкоциты (рис. 13-3а).
Ä Прогноз поверхностного гастрита благоприятный. Заболевание длится много лет, возможно обратное развитие.
Ä При H. pylori-ассоциированном антральном поверхностном гастрите в биоптатах и мазках-отпечатках при окраске по Гимзе выявляется H. pylori. После лечения антибактериальными препаратами и уничтожения бактерии H. pylori (эрадикация) в слизистой оболочке желудка происходит восстановление ультраструктуры клеток, из инфильтрата исчезают полиморфноядерные лейкоциты.
◊ Хронический атрофический гастрит отличается от поверхностного появлением атрофии. Слизистая оболочка истончена, её рельеф сглажен. Валики укорочены, плоские, но могут быть и в виде микропапиллярных разрастаний. Ямки углублены, штопорообразные. Покровно-ямочный эпителий уплощён. Главная клинико-морфологическая черта — не истончение слизистой оболочки, а уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замена их на более примитивные мукоциты. Последние при выраженной атрофии полностью вытесняют париетальные и главные клетки. Железы укорочены, количество их уменьшено. В собственной пластинке — поля склероза и полиморфноклеточный инфильтрат на месте бывших желёз. Помимо типичного покровно-ямочного и железистого эпителия нередко возникают очаги полной или неполной кишечной метаплазии, а также дисплазии эпителия (рис. 13-3б).
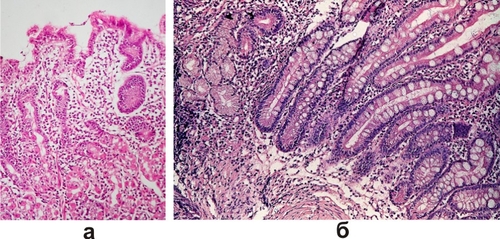
Рис. 13-3. Хронический гастрит: а — хронический поверхностный гастрит; б — хронический атрофический гастрит с перестройкой эпителия по кишечному типу. Окраска гематоксилином и эозином (x200).
Хронический атрофический гастрит — заболевание, длительно текущее без регресса атрофических изменений и сопутствующей кишечной метаплазии, т.к. механизмы, препятствующие обратному развитию атрофии, обусловлены изменением фенотипа эпителиоцитов в сторону уменьшения способности к апоптозу.
Прогноз. Хронический атрофический гастрит — предраковое заболевание желудка, поскольку на фоне тяжёлой дисплазии эпителия может развиться рак.
ЯЗВЕННАЯ БОЛЕЗНЬ
Язвенная болезнь (ЯБ) — широко распространённое заболевание, ей страдает приблизительно 10% населения земного шара. Частота язвенной болезни двенадцатиперстной кишки в 4–13 раз больше, чем язвенной болезни желудка, причём мужчины болеют в 2–7 раз чаще женщин.
В последние годы происходит уменьшение заболеваемости ЯБ в развитых странах, а с 50-х годов ХХ в. — постепенное снижение смертности. Это связано с применением новых фармакологических препаратов, снижением числа курящих, уменьшением инфицированности населения развитых стран H. pylori. Исследователи объясняют динамику смертности «феноменом когорты»: люди, родившиеся в последней четверти ХIХ в., имели максимальный риск смерти от ЯБ к середине ХХ в.; смертность от ЯБ стала ниже, когда состарилась когорта высокого риска. Данный феномен связывают с ранней фазой урбанизации, а также с особенно тяжёлыми стрессовыми ситуациями, пережитыми этим поколением.
Язвенная болезнь — хроническое, циклически текущее заболевание. Его основное морфологическое выражение — хроническая рецидивирующая язва желудка или двенадцатиперстной кишки.
Помимо язвы как проявления язвенной болезни желудка и двенадцатиперстной кишки существуют так называемые симптоматические язвы, т.е. изъязвления желудка и двенадцатиперстной кишки при других заболеваниях. Таковы язвы при эндокринных заболеваниях (синдром Золлингера-Эллисона, гиперпаратиреоз), при острых и хронических нарушениях кровообращения (дисциркуляторно-гипоксические язвы), при экзо- и эндогенных интоксикациях (токсические язвы), аллергии (аллергические язвы), хронических инфекциях (туберкулёзные, сифилитические язвы), после операций на желудке и кишечнике (послеоперационные пептические язвы), в результате медикаментозного лечения (стероидные язвы), а также при критических ситуациях (стрессовые язвы) или некоторых заболеваниях внутренних органов (гепатогенные язвы при циррозе печени).
Язвенная болезнь — чисто человеческое страдание, в её развитии основную роль играют стрессовые ситуации, что объясняет высокую заболеваемость язвенной болезнью во всех странах мира.
Факторы риска. ЯБ широко распространена. Её диагностируют, в основном, у лиц молодого и среднего возраста, чаще у мужчин, нередко как семейное заболевание с генетически наследуемой большой массой париетальных клеток. Нередко у больных обнаруживают группу крови I, дефицит α1-антитрипсина, отсутствие антигенов гистосовместимости, отвечающих за выработку гликопротеинов желудочной слизи (статус несекреторов).
Этиология. Со времен начала изучения проблемы ЯБ существовало множество гипотез. Впервые ЯБ была описана Ж. Крювелье, сторонником воспалительной теории болезни. К старым теориям относят сосудистую, пептическую, механическую, кортиковисцеральную, теорию обратной диффузии водородных ионов и другие, имеющие сегодня лишь исторический интерес. Ни одна из этих теорий не может полностью объяснить развитие ЯБ, все они — составные части общей схемы патогенеза.
Открытие H. pylori заставило пересмотреть взгляды на теорию язвенной болезни. Оказалось, что при язвенной болезни двенадцатиперстной кишки H. pylori обнаруживают у всех больных, а при язвенной болезни желудка — в 75–85%. Кроме того, независимо от локализации пептической язвы всегда присутствует хронический гастрит. Выяснение этиологической роли H. pylori заставило на качественно новом уровне вернуться к «гастритической» концепции возникновения ЯБ. Воспалительные и дисрегенераторные изменения слизистой оболочки, составляющие сущность хронического гастрита, снижают резистентность слизистой к воздействию факторов пептической агрессии и способствуют образованию язвы. Наличие антрального гастрита десятикратно увеличивает риск развития ЯБ. При выраженном атрофическом гастрите риск образования язвы выше в 20–30 раз.
Геном H. pylori содержит 1600 генов, 10% из них жизненно необходимы бактерии. Продукты генов, кодирующих синтез СagA, VacA, ice , bab и уреазы, активно участвуют в развитии процесса воспаления. Штаммы I типа, обладающие наибольшей цитолитической активностью, чаще всего обнаруживают при ЯБ. Наличие островка патогенности в геноме бактерии, маркёром которого является Сag, связано с более выраженным воспалением. Любой фактор, усиливающий воспаление, увеличивает риск возникновения ЯБ.
Важнейшее открытие в патогенезе ЯБ — обнаружение влияния H. pylori на желудочную секрецию. Кроме прямого влияния на регуляцию секреции, H. pylori воздействует и опосредованно, вызывая хронический гастрит. Образующийся под влиянием уреазы аммиак способствует увеличению pH слизистого слоя эпителия желудка, вмешиваясь в физиологический механизм отрицательной обратной связи между секрецией гастрина и хлористоводородной кислоты.
Развитие ЯБ двенадцатиперстной кишки связано со следующими важными факторами:
гиперсекреция соляной кислоты, в том числе, наследственно обусловленная, приводящая к желудочной метаплазии слизистой оболочки двенадцатиперстной кишки;
миграция H. pylori с током слизи из желудка в двенадцатиперстную кишку и последующее заселение её.
H. pylori влияет на секрецию и синтез гастрина путём воздействия на D-клетки. Известен дефицит D-клеток у больных ЯБ двенадцатиперстной кишки, т.е. бактерии влияют не только на G-клетки, но и на соматостатиновое звено регуляции. Это ведёт к характерному для больных ЯБ изменению концентрации гастрина, соматостатина в крови и количества эндокринных клеток в антральном отделе. Вырабатываемая микроорганизмом уреаза обладает сильными иммуногенными свойствами, способствует образованию цитокинов, свободных радикалов и цитотоксических продуктов (в первую очередь, вакуолизирующего цитотоксина VacA). Образование свободных радикалов связывают с секрецией H. pylori хемотаксического пептида и воспалительной реакцией в слизистой оболочке желудка в ответ на внедрение микроорганизма. Превращаясь в активные метаболиты кислорода, свободные радикалы оказывают непосредственное токсическое действие на эпителиоциты.
Уреаза способствует гидролизу мочевины в диоксид углерода и ион аммония. Аммиак взаимодействует с соляной кислотой, генерируемой нейтрофилами, образуя ряд цитотоксических продуктов, в том числе гидроксиамин (NH4OH) и монохлорамин (NH4Cl). Кроме того, липополисахариды и фосфолипазы А и C, выделяемые H. pylori, непосредственно повреждают эпителиоциты, снижают вязкость муцина и гидрофобные свойства слизистой оболочки, что способствует образованию микродефектов последней.
В 1995 г. доказаны постулаты Р. Коха о причинной роли H. pylori для язвенной болезни. И все же, если инфицированием H. pylori можно объяснить возникновение ЯБ двенадцатиперстной кишки и отчасти — пилороантральных язв желудка, то причина пептической язвы в теле желудка до конца не установлена. Обследование семей с генетической предрасположенностью к ЯБ показало, что наличия одного и того же вирулентного штамма бактерии недостаточно: ЯБ желудка оказалась не у всех родственников.
Локализация. Для ЯБ желудка характерная локализация хронической рецидивирующей язвы — тело желудка (медиагастральная язва) или пилороантральная область.
Для ЯБ двенадцатиперстной кишки характерна локализация язвы на передней или задней стенках луковицы двенадцатиперстной кишки. Обычно находят одну, реже две, крайне редко — три язвы.
Патогенез язвенной болезни зависит от локализации язв. Для ЯБ желудка и ЯБ двенадцатиперстной кишки с пилороантральной язвой он сходен и полностью отличается от патогенеза ЯБ желудка с медиагастральной локализацией язвы. На этом основании при изучении патогенеза выделяют пилородуоденальные язвы и язвы тела желудка.
Многочисленные патогенетические факторы, влияющие на развитие ЯБ, условно делят на общие и местные.
● Общие факторы — нарушения соотношений между факторами агрессии желудочного сока и факторами защиты слизистой оболочки желудка.
● Местные факторы — нарушения нервной и гормональной регуляции гастродуоденальной системы.
● Общие факторы патогенеза.
◊ Неврогенные факторы нарушают координирующую роль коры головного мозга в отношении подкорковых структур (промежуточного мозга, гипоталамуса). Пилородуоденальные язвы возникают на фоне возбуждения центров гипоталамо-гипофизарной области, центра блуждающего нерва, повышение тонуса последнего под влиянием стресса или патологии внутренних органов. Повышение тонуса блуждающего нерва приводит к активации кислотно-пептического фактора, нарушению моторики желудка и двенадцатиперстной кишки. Язвы тела желудка имеют противоположный патогенез: кора головного мозга угнетает функции гипоталамо-гипофизарной области, что неизбежно ведёт к снижению тонуса блуждающего нерва, в последующем возможно снижение активности желудочной секреции.
◊ Гормональные факторы развития ЯБ включают различные расстройства гипоталамо-гипофизарно-адреналовой системы. Пилородуоденальные язвы существуют на фоне избыточной продукции АКТГ и глюкокортикоидов, что также способствует повышению тонуса блуждающего нерва. Медиагастральные язвы, наоборот, возникают при снижении уровня этих гормонов.
● Местные факторы патогенеза:
факторы агрессии желудочного сока — соляная кислота и пепсиноген;
фактор защиты слизистой оболочки желудка — слизистый барьер.
Нарушения баланса факторов агрессии и защиты связано с изменением местной гормональной регуляции, моторикой желудка и/или двенадцатиперстной кишки, состоянием кровотока.
Пилородуоденальные язвы. Характерно значительное преобладание кислотно-пептического фактора агрессии над факторами защиты слизистой оболочки. Гиперсекреция соляной кислоты — основной патофизиологический механизм развития язв двенадцатиперстной кишки и пилорического отдела желудка. Увеличение количества соляной кислоты как минимум вдвое обусловлено повышенным содержанием гастрина в связи с гиперплазией G-клеток и гистамина, влияющих на париетальные клетки. Важную роль при этом играют двигательные расстройства: при язве двенадцатиперстной кишки обычно ускорена эвакуация желудочного содержимого из-за повышенной моторики желудка или беспорядочного аритмичного функционирования привратника. При этом укорочено время связывания соляной кислоты буферными компонентами пищи и активный желудочный сок поступает в кишку. Возможны и двигательные нарушения со стороны самой двенадцатиперстной кишки. При этом эвакуация из желудка нормальна, но замедлено прохождение комка пищи по кишке (дуоденостаз), что увеличивает время контакта слизистой оболочки кишки с кислым содержимым желудка. В обоих случаях нарушения моторики происходит кислотно-пептическое повреждение слизистой оболочки.
Язвы тела желудка. Активность кислотно-пептического фактора нормальна или даже слегка понижена, а на первом плане — ослабление факторов защиты слизистой оболочки, когда слизистый барьер желудка повреждён из-за обратной диффузии водородных ионов. Моторная функция не существенна для развития язв тела желудка.
H. pylori участвует в патогенезе ЯБ, усиливая факторы агрессии желудочного сока и ослабляя факторы защиты слизистой оболочки.
Ослабление факторов защиты возможно при прямом контакте H. pylori с мембранами эпителиоцитов желудка или двенадцатиперстной кишки. Под действием ионов аммония (уреаза H. pylori разлагает мочевину с образованием ионов аммония и углекислого газа), цитотоксинов, бактериальных ферментов происходит повреждение микроворсинок эпителиоцитов, разрушение их цитоскелета, межклеточных связей, изменение вязкости слизи. Ферменты H. pylori действуют на слизь, способствуя первоначально её липолизу и протеолизу, а затем деградации гликопротеинов и липидов. Феномен повреждения слизистого барьера C.S. Goodwin назвал образно «протекающей крышей».
Когда защитный слой слизи истончён или разрушен, возникает обратная диффузия водородных ионов и покровный эпителий, первоначально повреждённый прямым действием микроорганизма, получает ещё большее повреждение под действием водородных ионов, пепсина. В результате возникает сначала эрозия, а затем язва.
Существует и другой механизм воздействия H. pylori на кислотно-пептический фактор: адгезия H. pylori к эпителиальным клеткам вызывает в них экспрессию гена, кодирующего синтез ИЛ-8. Последний активизирует иммуноциты, что приводит к секреции различных цитокинов, включая ИЛ-2, ФНО-α ИФ-γ. Это, в свою очередь, может приводить к активации гена гастрина и гипергастринемии с последующим усилением синтеза кислоты. Соматостатиновый механизм торможения при этом не действует из-за щелочной среды — аммиака, образованного с помощью H. pylori.
Морфологический субстрат ЯБ — хроническая рецидивирующая язва. При формировании она проходит стадии эрозии, острой язвы и хронической язвы.
● Эрозия — поверхностный дефект, обычно не проникающий за мышечный слой слизистой оболочки. Они возникают в результате отторжения некротических масс с образованием многочисленных дефектов конической формы. Микроскопически в дне эрозий находят солянокислый гематин и лейкоцитарный инфильтрат. Большинство эрозий эпителизируется, но при ЯБ деструкция стенки желудка продолжается, некрозу подвержена не только слизистая оболочка, но и более глубокие слои стенки, формируется острая язва.
● Острая язва обычно имеет неправильную форму и мягкие на ощупь неровные края. По мере очищения от некротических масс обнажается дно, образованное пучками мышечных волокон стенки желудка, язва приобретает воронкообразную форму с основанием воронки, обращенным к слизистой, а верхушкой — к серозной оболочке. Острые язвы располагаются по малой кривизне в пилорическом и антральном отделах, т.е. по «пищевой дорожке» в местах наибольшего травмирования стенки желудка.
● Хроническая язва желудка обычно единичная (изредка две, ещё реже три язвы), овальной или округлой формы (ulcus rotundum), разных размеров (от нескольких миллиметров до 3,5 см). Она проникает в стенку на различную глубину, доходя иногда до серозной оболочки. Дно язвы может быть гладким и шероховатым, края приподняты, плотные, омозолелые (каллёзная язва), при этом кардиальный край язвы подрыт, а край, обращенный к привратнику — пологий, иногда имеет вид террасы. Подобная конфигурация обусловлена постоянным смещением краёв при перистальтике желудка.
Микроскопическая картина хронической язвы желудка зависит от стадии заболевания: обострение или ремиссия.
● В период ремиссии в дне язвы видна рубцовая ткань, вытесняющая мышечную оболочку стенки желудка на определённую глубину. Среди рубцовой ткани — одиночные сосуды со склерозированными стенками и суженным просветом, иногда разрастания нервных волокон, напоминающие ампутационные невромы. На поверхности рубцовая ткань чаще всего покрыта слизистой оболочкой, хотя последняя обычно отсутствует при крупных язвах. В краях язвы — признаки гиперплазии эпителия, характерные для хронического гастрита.
● В период обострения в области дна и краёв заметна широкая зона фибриноидного некроза, прикрытая сверху фибринозно-гнойным экссудатом. Снизу эту зону обрамляет грануляционная ткань. В глубине дна язвы — зона грубоволокнистой рубцовой ткани. Об обострении язвы говорят не только экссудативно-некротические изменения дна язвы, но и фибриноидные изменения стенок сосудов. В связи с появлением в дне язвы свежих очагов некроза размеры язвы в период обострения увеличиваются в глубину и в ширину, создавая опасность развития тяжёлых деструктивных осложнений (рис. 13-4).
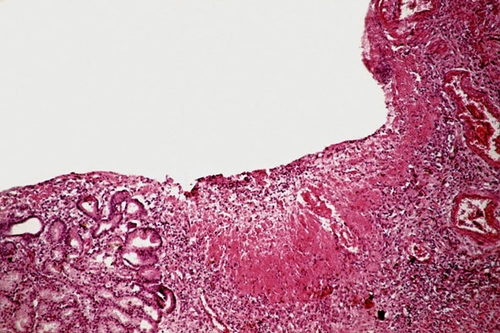
Рис. 13-4. Хроническая язва желудка с подрытым кардиальным и пологим пилорическим краями. Окраска гематоксилином и эозином (x100).
Заживление язвы начинается с постепенного очищения дна язвы от некротических масс и рассасывания экссудата. Зону некроза прорастает грануляционная ткань, она постепенно созревает в грубоволокнистую рубцовую ткань. Одновременно регенерирующий эпителий с краёв язвы начинает «наплывать» на дно. Процесс регенерации эпителия и соединительной ткани должен происходить синхронно. Эпителий стимулирует рост и созревание соединительной ткани, вырабатывая коллагеназу, необходимую для перестройки рубца. Когда эпителизация дна язвы задерживается, возникает преждевременный склероз грануляционной ткани. Это ещё более замедляет эпителизацию, создавая порочный круг. Эпителий, первоначально одним рядом закрывший дно язвы, продолжает регенерировать, и со временем в дне язвы формируется полноценная слизистая оболочка. Первоначально под новообразованной слизистой оболочкой видна грануляционная ткань с её многочисленными кровеносными сосудами (красный рубец). По мере созревания грануляционной ткани эндоскопическая картина меняется, возникает белый рубец.
Морфогенез и патологическая анатомия хронической язвы двенадцатиперстной кишки и желудка сходны, за исключением сроков заживления. Хроническая язва желудка заживает за восемь недель, язва двенадцатиперстной кишки — за шесть недель. Подслизистая основа и мышечная оболочка в области дна язвы не восстанавливаются, а замещаются рубцом. Таким образом, широко распространённый термин «рубец после язвы» имеет отношение к подслизистой основе и мышечной оболочке стенки желудка, тогда как слизистая оболочка регенерирует без формирования рубца. Поскольку полной регенерации в дне язвы желудка не происходит, заболевание протекает хронически, волнообразно, с обострениями и ремиссиями.
Прогрессирование язвенного процесса проявляется очередным расширением и углублением язвенного дефекта. При этом различают два варианта увеличения размеров язвы:
центрифугальный — за счёт разрушения краёв язвы;
центрипетальный — за счёт образования эрозий и острых язв около хронической язвы с последующим их слиянием; глубину язвы увеличивает некроз в области дна.
Осложнения язвенной болезни. При ЯБ желудка и двенадцатиперстной кишки возможны осложнения деструктивные (перфорация язвы, кровотечение, пенетрация); воспалительные (гастрит, перигастрит, дуоденит, перидуоденит) и рубцовые (стеноз входного и выходного отверстий желудка, стеноз и деформация луковицы двенадцатиперстной кишки, деформация желудка). Наиболее частые из этих осложнений — кровотечение и перфорация.
● Кровотечение наблюдают у 16–37% больных с незажившими язвами. При дуоденальных язвах кровотечение возникает вдвое чаще. Летальность при кровоточащих дуоденальных язвах составляет 1–7%, при язвах желудка 1–16%. Особенно высока смертность от кровотечений у лиц пожилого возраста. У больных моложе шестидесяти лет она составляет 4%, старше семидесяти лет — 20%. Кровотечение связано с аррозией сосудов дна язвы, поскольку стенки сосудов за годы течения ЯБ склерозированы и гиалинизированы. В период обострения, когда в сосудах развивается фибриноидный некроз, они длительное время не спадаются, что приводит к фатальному кровотечению.
● Перфорация стенки с развитием перитонита занимает второе место среди осложнений. Это осложнение возникает всего в 5% случаев, однако ему принадлежит первое место среди причин смерти больных ЯБ — 2/3 всех случаев. Чаще всего перфорируют пилородуоденальные язвы — в шесть раз чаще, чем язвы тела желудка. Ежегодно частота перфорация язв составляет 7–10 случаев на 100 тыс. населения.
