
Гормональная регуляция
Расщепление гликогена в мышцах контролируют гормоны:
Гликогенолиз стимулируется адреналином (через b-рецепторы) за счет образования цАМФ и активации киназы фосфорилазы. Активация фосфорилазы наступает также при увеличении концентрации ионов Са2+ во время мышечного сокращения.
Расщепление и синтез мышечных белков контролируют гормоны:
тестостерон и синтетические анаболики стимулируют синтез белка; кортизол подавляет образование мышечных белков.
Из всех способов синтеза АТФ наиболее продуктивно окислительное фосфорилирование – оно обеспечивает потребности в АТФ постоянно работающей сердечной мышцы (используется самый энергоёмкий субстрат окисления – жирные кислоты). Поэтому для успешной работы сердца обязательным условием является достаточное снабжение кислородом (инфаркт миокарда — результат ишемии вследствие сбоев в поступлении О2).
Скелетные мышцы содержат медленные (красные) и быстрые (белые) волокна (волокна I и II типа).
В малоактивных белых скелетных мышцах, лишенных красного миоглобина и его О2, главный источник энергии для восстановления АТФ – анаэробный гликолиз. В первые 5 с как источник энергии тратится креатинфосфат. Затем используется глюкоза, полученная из гликогена и дающая энергию в гликолизе. Гликоген мышц расходуется быстро. Эти мышцы сохраняют способность к быстрым сокращениям, но работают лишь короткое время, поскольку при гликолизе образуется мало АТФ. Мышцы быстро истощаются в результате изменения рН в миоцитах. (таких мышц много у СПРИНТЕРов).
Для высокоактивных красных скелетных мышц характерны окислительные процессы, они содержат миоглобин и митохондрии, в них источник энергии для рефосфорилирования АДФ – окислительное фосфорилирование в митохондриях. В результате основным источником энергии для работы таких мышц становится АТФ, образующаяся при тканевом превращении глюкозы и жирных кислот крови. Гликоген мышц истощается медленно. В обеспечении этих мышц кислородом принимает участие миоглобин, который обладает свойством запасать О2 (таких мышц много у СТАЙЕРов, марафонцев).
Миоглобин (ММ 17 кДа) – одиночная цепь из 153 аминокислот, по структуре сходна с β-цепью гемоглобина, имеет гем и ион Fe2+ (содержание железа от 3 до 20 % общего количества).
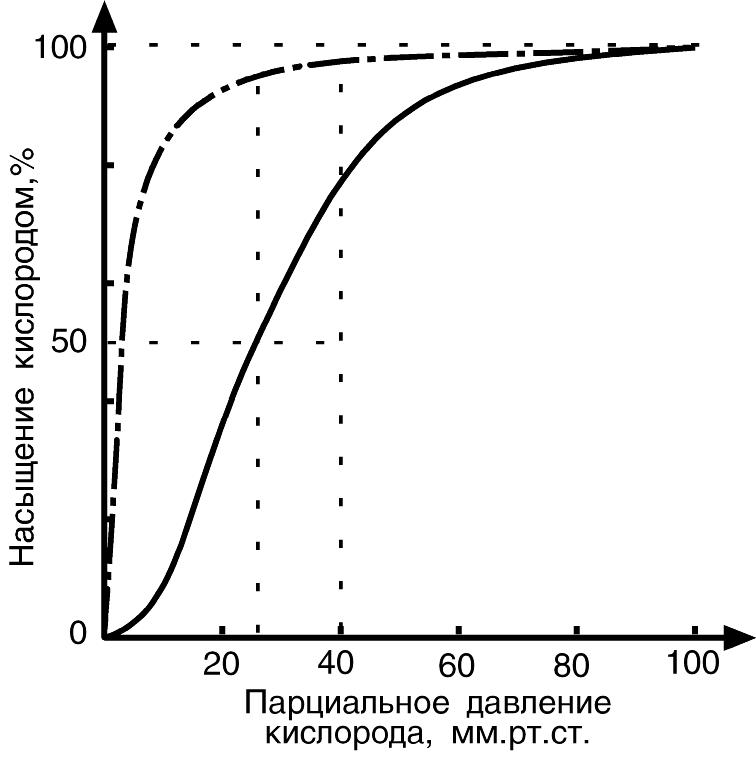
Миоглобин обладает более высоким сродством к О2 чем Hb. Это обуславливает функцию миоглобина – депонировать О2 и длительное время находиться в виде оксимиоглобина в покоящейся мышце (pO2 около 40 мм рт.ст.) и даже в ходе умеренной мышечной работы (pO2 около 20 мм рт.ст.), а использовать его только в ходе очень тяжелой и интенсивной работы при значительном снижении парциального давления О2 в мышце (до 1-2-3 мм Hg). СМ РИСУНОК НИЖЕ
Итак, миоглобин остаётся оксигенированным, пока количество О2 в клетке не снизится до предела, лишь тогда он начинается отдавать О2 для метаболизма и использования в дыхательной цепи митохондрий.
К ривые
насыщения кислородом показывают отличия
миоглобина и Hb:
ривые
насыщения кислородом показывают отличия
миоглобина и Hb:
одно и то же 50%-е насыщение
 достигается
при разных концентрациях кислорода –
около 26 мм Hg
для Hb
и около 5 мм Hg–
для миоглобина;
достигается
при разных концентрациях кислорода –
около 26 мм Hg
для Hb
и около 5 мм Hg–
для миоглобина;при физиологическом парциальном давлении кислорода 26 - 40 мм Hg гемоглобин насыщен на 50-80%, а миоглобин – почти на 100%.
Основной функцией мышц является сократительная – преобразование энергии химических связей в механическую работу. В мышечном волокне это преобразование осуществляют белки миофибрилл, способные многократно сокращаться и возвращаться к исходному состоянию
Сокращение мышечных волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов относительно друг друга.
МЕХАНИЗМ. Сокращение мышечных волокон – результат цикла реакций:
1. В отсутствие АТФ, т.е. в исходном состоянии, головки молекул миозина прочно связаны с нитями актина. Связывание АТФ ведёт к отделению головки от нитей актина.
2. АТФ-аза головок миозина гидролизует АТФ на АДФ и фосфат, но продолжает удерживать оба продукта реакции близко друг от друга. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке.
3. Головка миозина образует новый мостик с соседней молекулой актина.
4. Актин ускоряет выброс продуктов АТФ-азной реакции из активного центра миозина. Это приводит к преобразованию аллостерического напряжения и изменению конформации головки миозина, которое действует подобно «удару весла» (модель весельной лодки). Во время этого «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового филамента по направлению к Z-диску. Цикл повторяется до тех пор, пока имеется АТФ.
Каждый «гребок» 500 миозиновых головок толстого филамента вызывает смещение на 10 нм. Во время сильных сокращений частота «гребков» ≈ 5 раз в секунду. При каждом цикле гидролиза АТФ головки миозина взаимодействуют с новыми молекулами актина, за счет чего и происходит взаимное скольжение миозиновых и актиновых филаментов (сокращение мышечного волокна).
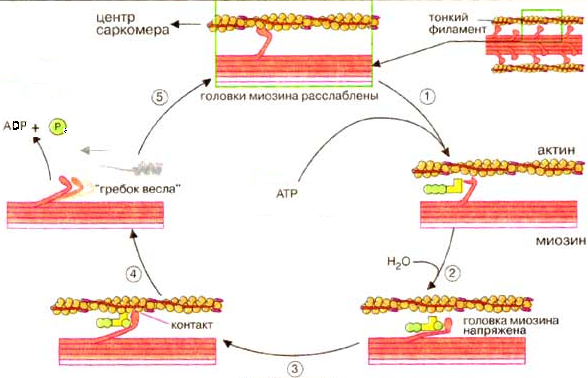
Рис. МЕХАНИЗМ сокращения мышечных волокон
Биохимические механизмы мышечного сокращения и расслабления.
Большую роль в этом процессе играют ионы кальция и саркоплазматические белки — кальсеквестрин и белок с высоким сродством к кальцию. Мембраны саркоплазматического ретикулума окружают мышечные нити. Эти белки расположены в цистернах СПР на внутренней мембране, где связывают ионы Са2+. Кальсеквестрин — кислый гликопротеин (ММ 45 000 Да), способен присоединять 45 ионов Са2+, белок с высоким сродством к кальцию (ММ 55 000 Да) связывает 25 ионов Са2+. Перенос Са2+ из цистерн происходит по градиенту концентрации простой диффузией; перенос Са2+ из цитоплазмы в цистерны — против градиента при участии Са2+-зависимой АТФазы и АТФ. В состоянии покоя система активного транспорта накапливает кальций в цистернах. Сокращение мышцы начинается с прихода потенциала действия на концевую пластинку двигательного нерва. В синапс выделяется ацетилхолин, который связывается с постсинаптическими рецепторами мышечного волокна. Далее потенциал действия распространяется вдоль сарколеммы к поперечным трубочкам Т-системы. В области Z-линий происходит передача сигнала от поперечных трубочек на цистерны саркоплазматического ретикулума.
Деполяризация мембран цистерн приводит к высвобождению кальция и началу мышечного сокращения. Кальций связывается с субъединицей С тропонина. Это изменяет конформацию всей молекулы тропонина — субъединица I перестает мешать взаимодействию актина с миозином; изменение конформации субъединицы Т передается на тропомиозин. Далее тропомиозин поворачивается на 20° и открывает закрытые ранее центры в актине для связывания с миозином. Головка миозина, которая в покое представляет собой комплекс АДФ+Фн+миозин, присоединяется к актину перпендикулярно, причем актин обладает к этому комплексу большим сродством (образование поперечных мостиков). Присоединение актина вызывает быстрое освобождение АДФ и Фн из миозина. Это приводит к изменению конформации, и головка миозина поворачивается на 45° (рабочий ход). Поворот головки, связанной с актином, вызывает перемещение тонкой нити относительно миозина. К головке миозина вместо ушедших АДФ и Фн вновь присоединяется АТФ, образуя комплекс М+АТФ. Актин обладает к нему малым сродством, что вызывает отсоединение головки миозина (разрыв поперечных мостиков). Она вновь становится перпендикулярно тонкой нити. В головке миозина, не связанной с актином, происходит гидролиз АТФ. Вновь образуется комплекс АДФ+Фн+миозин, и все повторяется. Присоединение АТФ к миозину и гидролиз АТФ происходят очень быстро, однако продукты гидролиза АДФ и Фн отщепляются от миозина медленно.
После прекращения действия двигательного импульса Са2+ с помощью Са2+-зависимой АТФазы переходит в саркоплазматический ретикулум. Уход кальция из комплекса тропонина приводит к смещению тропомиозина и закрытию активных центров актина, делая его неспособным взаимодействовать с миозином, — мышца расслабляется.
Для здоровья мышечной ткани важны процессы нервно-мышечной передачи. 1) При миастении в крови находят антитела против собственных рецепторов ацетилхолина, что проявляется мышечной слабостью. 2). Ряд лекарственных препаратов (атропин, сукцинилхолин, яд кураре) ингибируют рецепторные белки, чем блокируют нервно-мышечное проведение. 3). Лекарственные препараты (неостигмин, эзерин) ингибируют ацетилхолин-эстеразу, тем самым, усиливая действие ацетилхолина. 4). Более мощными ингибиторами фермента являются органические фторфосфаты. Они образуют прочную связь с ацетилхолинэстеразой и вызывают смерть от остановки дыхания. Это нервно-паралитические яды — табун, зарин.
