- •Вопросы по теме 4. Основы современных концепций микро - и наномира
- •3. Кратко сформулируйте, что такое атомная «орбиталь»? Какими формами характеризуют электронные орбитали, которые занимают определенное положение в пространстве (расположение в пространстве)?
- •4. Какие 4 параметра используют в современной квантовой теории для полного описания состояния электрона в атоме? Поясните, что определяет главное квантовое число ?
- •5. Какие 4 параметра используют в современной квантовой теории для полного описания состояния электрона в атоме? Поясните, что определяет орбитальное (побочное) квантовое число l?
- •14. Что характерно для атомных орбиталей металлов? Что характеризует энергия ионизации? Какие щелочные металлы обладают самыми малыми значениями энергии ионизации?
- •15. Что характерно для атомных орбиталей неметаллов? Что характеризует сродство к электрону? Какое вещество называют окислителем? Какие сильные окислители Вам известны?
- •16. Кратко опишите, что представляет в современном понимании такая сущность, как химическая связь. По какой причине образуется химическая связь между атомами водорода?
- •17. Кратко сформулируйте, какие бывают виды химической связи. Что такое ионная связь? Поясните, между какими атомами и как она образуется?
- •18. Кратко сформулируйте, какие бывают виды химической связи. Что такое ковалентная связь? Поясните, между какими атомами и как она образуется? Какие разновидности ковалентной связи Вам известны?
- •19. Кратко сформулируйте, что такое ковалентная связь? Поясните, как образуется σ - связь?
- •27. Кратко сформулируйте, какие бывают виды химической связи. Что такое молекулярная связь? Поясните, между какими атомами и как она образуется?
- •28. Какие разновидности молекулярного кислорода Вам известны? Как они различаются по химической активности?
- •32. На какие группы, по способности проводить ток, различаются кристаллические твердые тела? Что такое полупроводники и чем они характеризуются?
- •35. Что такое энергетическая диаграмма полупроводникового кристалла? Почему ее используют? Какими параметрами, на основании энергетической диаграммы, характеризуют полупроводниковые материалы?
- •36. Что такое энергетическая диаграмма полупроводникового кристалла? Почему ее используют? в чем различие энергетических диаграмм собственного и примесного полупроводников?
- •39. Поясните, что означает аллотропия веществ? Какие виды аллотропных форм углерода Вам известны? Чем характеризуется такая форма, как графит?
- •40. Поясните, что означает аллотропия веществ? Какие виды аллотропных форм углерода Вам известны? Чем характеризуется такая форма, как гексагональный алмаз (или лонсдейлит)?
- •43. Поясните, что означает аллотропия веществ? Чем характеризуется такая форма структур, как углеродные нанотрубки? Какими необычными физическими свойствами обладают нанотрубки?
- •44. Как меняются свойства объектов при уменьшении их наноразмеров? Что такое эффект лотоса? Как его можно использовать?
- •45. Кратко сформулируйте, почему человек стремится познать «тайны» наномира. Какие преимущества дает использование свойств наномира, и какие перспективы это открывает для нанотехнологий?
- •46. Кратко сформулируйте, почему человек стремится для решения проблемы энергопотребления использовать наномир и разрабатывать нанотехнологии.
- •48. Что представляет собой композиционный материал? Из каких двух основных компонент он состоит? Чего можно добиться комбинируя объемное содержание компонентов?
- •49. Какими свойствами, достоинствами и недостатками характеризуются современные композиционные материалы и в каких отраслях промышленности они находят применение?
- •50. Какие прогрессивные композитные материалы используют в автомобилестроении. В чем их достоинства и недостатки по сравнению с традиционными материалами, используемыми в автомобилях?
- •51. Какие прогрессивные композитные материалы используют в авиастроении. В чем их достоинства и недостатки по сравнению с традиционными материалами, используемыми в самолетах?
- •52. Какие преимущества получены в самолетах Boeing 787 Dreamliner, a350 xwb компании "Эрбас" за счет использования композиционных материалов?
18. Кратко сформулируйте, какие бывают виды химической связи. Что такое ковалентная связь? Поясните, между какими атомами и как она образуется? Какие разновидности ковалентной связи Вам известны?
Основными типами химической связи являются ионная, ковалентная, металлическая и водородная.
Ковалентная связь - химическая связь, образованная притяжением атомов за счет обменного взаимодействия между неспаренными электронами соседних атомов (электроны внешних незаполненных оболочек стремятся образовать единую оболочку молекулы). Ковалентная связь является результатом электронно-ядерных взаимодействий в веществе, характеризуемых направленностью и насыщаемостью.
Ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака, соответствующего валентным электронам. При этом осуществляется перекрытие облаков связующих электронов. Это и означает, что ковалентная связь имеет направленный характер, который играет важную роль в определении пространственного расположения атомов в решетке и для результата электронно-ядерных взаимодействий.
Виды ковалентной связи 1)
![]() -связь
(сигма –связь); 2)
-связь
(сигма –связь); 2)
![]() -
связь (пи – связь).
-
связь (пи – связь).
19. Кратко сформулируйте, что такое ковалентная связь? Поясните, как образуется σ - связь?
Ковалентная связь - химическая связь, образованная притяжением атомов за счет обменного взаимодействия между неспаренными электронами соседних атомов (электроны внешних незаполненных оболочек стремятся образовать единую оболочку молекулы). Ковалентная связь является результатом электронно-ядерных взаимодействий в веществе, характеризуемых направленностью и насыщаемостью.
Если атомы характеризуются орбиталью в виде «лепестка», то при их сближении и образовании молекулы электронные облака могут перекрываться в направлении прямой (оси координат), которая соединяет ядра атомов (то есть по оси связи). При образовании такой химической связи всегда происходит сдвиг электронной плотности в направлении перекрывания, а это приводит к изменению формы орбиталей по сравнению с их состоянием в свободном атоме.
Ковалентные σ-связи образуются при перекрывании орбиталей p-p (Cl2). Ковалентная связь между атомами образуется при перекрывании атомных орбиталей, например 2p-орбиталей при образовании связи Cl- Cl.
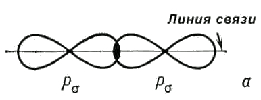
20. Кратко сформулируйте, что такое ковалентная связь? Поясните, как образуется пи – связь? Ковалентная связь - химическая связь, образованная притяжением атомов за счет обменного взаимодействия между неспаренными электронами соседних атомов (электроны внешних незаполненных оболочек стремятся образовать единую оболочку молекулы). Ковалентная связь является результатом электронно-ядерных взаимодействий в веществе, характеризуемых направленностью и насыщаемостью.
При перекрытии р-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Следует иметь в виду, что из-за большего взаимного удаления областей «перекрывания» - связь оказывается более слабой.
21. Кратко сформулируйте, что такое ковалентная связь? Поясните, что такое кратность ковалентной связи и чем она определяется? Какие разновидности кратной связи Вам известны?
Ковалентная связь - химическая связь, образованная притяжением атомов за счет обменного взаимодействия между неспаренными электронами соседних атомов (электроны внешних незаполненных оболочек стремятся образовать единую оболочку молекулы). Ковалентная связь является результатом электронно-ядерных взаимодействий в веществе, характеризуемых направленностью и насыщаемостью.
Число общих электронных пар, которые связывают атомы, характеризует кратность ковалентной связи.
Связь между двумя атомами при помощи одной электронной пары электронов называется простой. Связь между двумя атомами при помощи двух электронных пар называется двойной. Связь между двумя атомами при помощи трех электронных пар называется тройной. Например, двойная связь имеет место между атомами углерода в этилене, тройная связь наблюдается в молекулах азота, ацетилена.
22. Кратко сформулируйте, что такое ковалентная связь? Поясните, какой пространственной структурой (то есть определенной формой в пространстве) она может характеризоваться. Какие орбитали – гибриды Вам известны?
Ковалентная связь - химическая связь, образованная притяжением атомов за счет обменного взаимодействия между неспаренными электронами соседних атомов (электроны внешних незаполненных оболочек стремятся образовать единую оболочку молекулы). Ковалентная связь является результатом электронно-ядерных взаимодействий в веществе, характеризуемых направленностью и насыщаемостью.
Также надо иметь в виду, что процесс образования ковалентной связи характеризуется пространственной структурой (то есть определенной формой в пространстве). Перекрывание атомных орбиталей при формировании двухатомных молекул АВ (А и В - атомы одного или разных элементов) может приводить не только к линейной геометрической форме молекул (Н−Н, F−F, H−Cl). Образование ковалентных химических связей в многоатомных молекулах может приводить к изменению расположения орбиталей в пространстве (не в линию, а под различными углами). Кроме того при образовании молекул, как в 1931 году показал американский химик Л. Полинг, может происходить процесс гибридизации или, образования орбиталей - гибридов у центрального атома А.
В
частности, при образовании С-Н связей
в метане
![]() участвуют гибридные орбитали грушевидной
формы, обозначающиеся символами
участвуют гибридные орбитали грушевидной
формы, обозначающиеся символами
![]() .
Получившиеся орбитали - гибриды одинаковы
по форме и внешне напоминают асимметричные
объемные восьмерки. Вытянутая форма
орбиталей обеспечивает более сильное
перекрытие с орбиталями присоединяющихся
к углерода атомов и тем самым стабилизирует
молекулу.
.
Получившиеся орбитали - гибриды одинаковы
по форме и внешне напоминают асимметричные
объемные восьмерки. Вытянутая форма
орбиталей обеспечивает более сильное
перекрытие с орбиталями присоединяющихся
к углерода атомов и тем самым стабилизирует
молекулу.

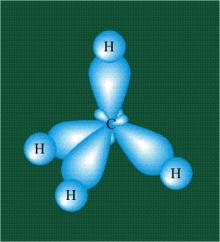
23. Кратко сформулируйте, какие бывают виды химической связи? Поясните, за счет каких гибридно-орбитальных связей образуется молекула метана .
Основными типами химической связи являются ионная, ковалентная, металлическая и водородная.
За счет гибридных орбиталей атома углерода и s- орбиталей водорода
24. Кратко
сформулируйте, какие бывают виды
химической связи? Поясните, за счет
каких гибридно-орбитальных связей
образуется молекула этилена
![]() .
.
Основными типами химической связи являются ионная, ковалентная, металлическая и водородная.
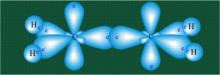
За счет σ- связи (s-орбиталь и две р-орбитали рх и ру) и -связи двух орбиталей pz.
25. Кратко
сформулируйте, какие бывают виды
химической связи? Поясните, за счет
каких гибридно-орбитальных связей
образуется молекула бензола
![]() .
.
Основными типами химической связи являются ионная, ковалентная, металлическая и водородная.
За счет σ- связи (s-орбиталь и две р-орбитали рх и ру) и -связи двух орбиталей pz. У бензола остов молекулы собран из атомов углерода имеющих гибридные орбитали, составленные из одной s- и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена). Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла.
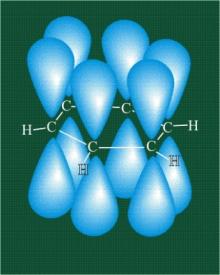
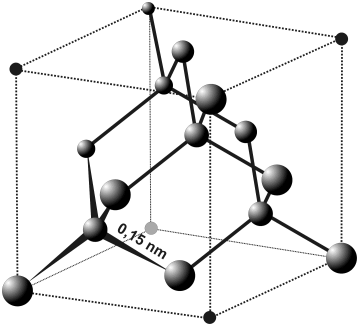
26. Кратко сформулируйте, какие бывают виды химической связи? Поясните, за счет каких гибридно-орбитальных связей образуется кристалл углерода, который называют алмаз. Что характерно для кристалла алмаза и какими важными свойствами он обладает?
Основными типами химической связи являются ионная, ковалентная, металлическая и водородная.
Типичным примером кристаллических структур с ковалентной связью является алмаз. Кристаллическая решетка — кубическая гранецентрированная. Атомы углерода в алмазе находятся в состоянии sp³-гибридизации. Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Именно прочная связь атомов углерода объясняет высокую твёрдость алмаза.
Энергия ковалентной связи высока - порядка сотен килоджоуль на моль. Поэтому ковалентные кристаллы обладают высокой прочностью, твердостью, имеют высокие точки плавления.