
- •Введение
- •Основные понятия и определения
- •Виды и методы измерений Виды измерений
- •Классификация физических величин
- •Размер физических величин. “Истинное значение” физических величин
- •Основной постулат и аксиома теории измерений
- •Теоретические модели материальных объектов, явлений и процессов
- •Физические модели
- •Математические модели
- •Единицы, системы единиц.
- •3. Системы единиц физических величин
- •3.1. Система Гаусса
- •3.2. Система сгс
- •3.3. Система мкгсс
- •3.4. Система мтс
- •3.5. Международная система единиц физических величин
- •3.5.1. Важнейшие достоинства Международной системы единиц
- •3.5.2. Основные единицы си и их определения
- •3.5.3. Принцип построения производных единиц си
- •3.5.4. Десятичные кратные и дольные единицы си и правила их образования
- •3.5.5. Относительные и логарифмические единицы си
- •3.5.6. Единицы количества информации си
- •3.5.7. Внесистемные единицы си
- •3.5.8. Правила написания наименований и обозначений единиц си
- •Погрешности измерений
- •Причины возникновения и способы исключения систематических погрешностей
- •Основные характеристики измерительных приборов и преобразователей
- •Обшие сведения об измерительных системах
- •Классификация сигналов и помех.
- •Классификация помех
- •Эффект Доплера для звуковых волн.
- •Фотоэффект
- •Кристаллическое состояние Отличительные черты кристаллического состояния
- •Физические типы кристаллических решеток
- •Дефекты в кристаллах
- •Теплоемкость кристаллов
- •Эффект Холла
- •Эффект Джозефсона.
- •Туннельный эффект
- •Стационарный эффект Джозефсона
- •Нестационарный эффект Джозефсона Туннелирование куперовских пар при электрическом напряжении
- •Нестационарный эффект Джозефсона в фундаментальных физических экспериментах
- •Квантовая интерференция
- •Сверхпроводниковые квантовые интерферометры
- •Сверхпроводниковый суперкомпьютер
Кристаллическое состояние Отличительные черты кристаллического состояния
Подавляющее большинство твердых тел в природе имеет кристаллическое строение. Так, например, почти все минералы и все металлы в твердом состоянии являются кристаллами.
Характерная черта кристаллического состояния, отличающая его от жидкого и газообразного состояний, заключается в наличии анизотропии, т. е. зависимости ряда физических свойств (механических, тепловых, электрических, оптических) от направления.
Тела, свойства которых одинаковы по всем направлениям, называются изотропными.
Причиной анизотропии кристаллов служит упорядоченное расположение частиц (атомов или молекул), из которых они построены. Упорядоченное расположение частиц проявляется в правильной внешней огранке кристаллов. Кристаллы ограничены плоскими гранями, пересекающимися под некоторыми, определенными для каждого данного рода кристаллов, углами. Раскалывание кристаллов легче происходит по определенным плоскостям, называемым плоскостями спайности.
Правильность геометрической формы и анизотропия кристаллов обычно не проявляются по той причине, что кристаллические тела встречаются, как правило, в виде поликристаллов, т.е. конгломератов множества сросшихся между собой, беспорядочно ориентированных мелких кристалликов. Создав специальные условия кристаллизации из расплава или раствора, можно получить большие одиночные кристаллы — монокристаллы любого вещества. Монокристаллы некоторых минералов встречаются в природе в естественном состоянии.
Упорядоченность расположения атомов кристалла заключается в том, что атомы (или молекулы) размещаются в узлах геометрически правильной пространственной решетки. Весь кристалл может
Рис. 1.
быть получен путем многократного повторения в трех различных направлениях одного и того же структурного элемента, называемого элементарной кристаллической ячейкой (рис. 1, а). Длины ребер а, Ь и с кристаллической ячейки называются периодами идентичности кристалла.
Рис. 2.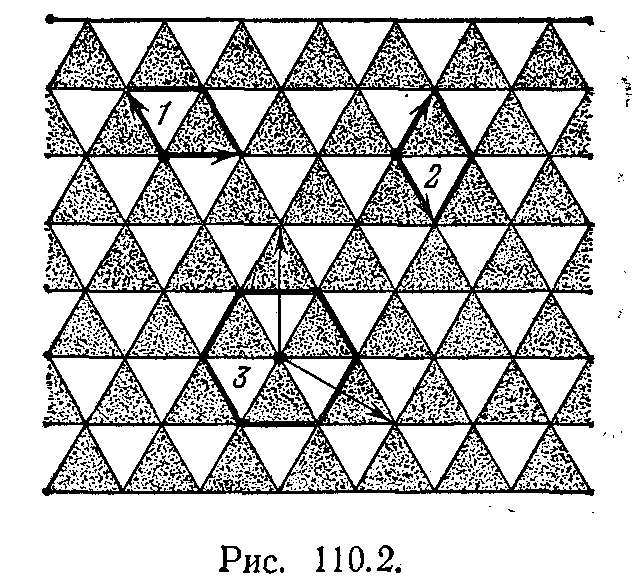
Физические типы кристаллических решеток
В зависимости от природы частиц, помещающихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решеток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
I. Ионные кристаллы. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия
Рис. 1.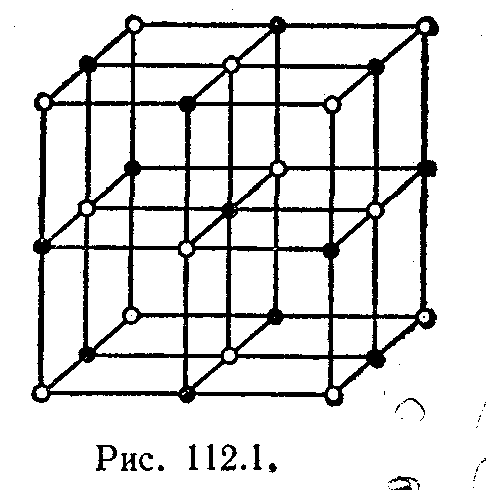
Типичным примером ионной решетки может служить изображенная на рис. 1 решетка каменной соли NаС1. Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками — отрицательные ионы хлора. Как видно из рисунка, ближайшими соседями иона данного знака будут ионы противоположного знака. В газообразном состоянии NaCl состоит из молекул, в которых объединяются попарно ионы натрия с ионами хлора. Образующая молекулу группировка из иона Na и иона С1 утрачивает в кристалле обособленное существование.
Ионный кристалл состоит не из молекул, а из ионов.
2. А т о м н ы е к р и с т а л л ы. В узлах кристаллической решетки помещаются нейтральные атомы.
Типичными примерами атомных кристаллов могут служить алмаз и графит. Оба эти вещества тождественны по химической природе (они построены из атомов углерода), но отличаются кристаллическим строением. На рис. 2, а показана решетка алмаза, на рис. 2,6—решётка графита.
Для этой решетки алмаза характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями, расположенными в вершинах правильного тетраэдра.
Рис. 2.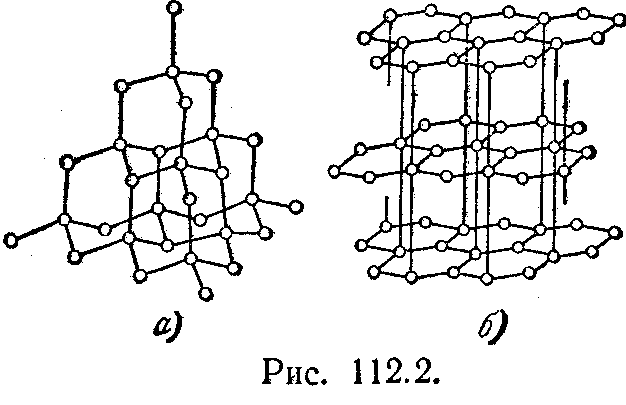
4. Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности.
Молекулярные решетки образуют, например, следующие вещества:
Нг, Na, Оз, СОа, НаО. Таким образом, обычный лед, а также так называемый сухой лед (твердая углекислота) представляют собой молекулярные кристаллы.
