
- •Полимеризация
- •Классификация и номенклатура вмс
- •Синтез высокомолекулярных соединений
- •Радикальная полимеризация
- •Кинетика радикальной полимеризации
- •Методы изучения процесса радикальной полимеризации
- •Гель проникающая хроматография
- •Электронный парамагнитный резонанс (эпр)
- •Способы проведения полимеризации
- •Анионная полимеризация
- •Ионная (каталитическая) полимеризация
- •Кинетика катионной полимеризации
- •Анионная полимеризация
- •Кинетика анионной полимеризации
- •Стереоспецифическая полимеризация
- •Механизм смтереспецифическйо полимеризации
- •Сополимеризация
- •Определение констант сополимеризации. Их физический смысл.
- •Ингибирование и регулирование полимеризации
Кинетика радикальной полимеризации
Рассмотрим ПМ в общем виде, когда нет осложнения такими факторами как вязкость, затрудненный отвод тепла, выделяющегося при реакции.
Допущения:
1. Реакционная способность радикалов, образующихся в процессе ПМ, не зависит от длины цепи;
2. Радикальная цепь участвует только в реакции с мономером, доля всех побочных процессов ничтожно мала;
3. Для вывода кинетических уравнений воспользуемся принципом стационарного состояния введенным Боденштейном. Сущность этого принципа заключается в следующем. В реакционной системе с какого-то момента начинают образовываться активные центры, дающие начало цепной реакции; при радикальной ПМ – это свободные радикалы. Одновременно в результате обрыва цепи активные центры (в случае ПМ – макрорадикалы) начинают исчезать. Концентрация радикалов возрастает во времени, но рост концентрации радикалов приводит к тому, что скорость обрыва цепи также возрастает. В результате через некоторое время число исчезающих радикалов будет равно числу образующихся радикалов (за одинаковый промежуток времени), и в системе установится постоянная, стационарная концентрация растущих радикалов.
С момента установления стационарного состояния скорость инициирования цепи будет равна скорости обрыва цепи.
Wин=Wобр.
Ранее было показано (уравнения 3, 4, 8), что
Следовательно
Скорость ПМ в стационарном состоянии равна скорости роста цепи. Реакция роста цепи осуществляется путем взаимодействия активного центра с молекулой полимера, и поэтому скорость этой реакции может быть найдена по уравнению:
W=WP=KP[M][R]
Из уравнения (9) определим [R]
[R]=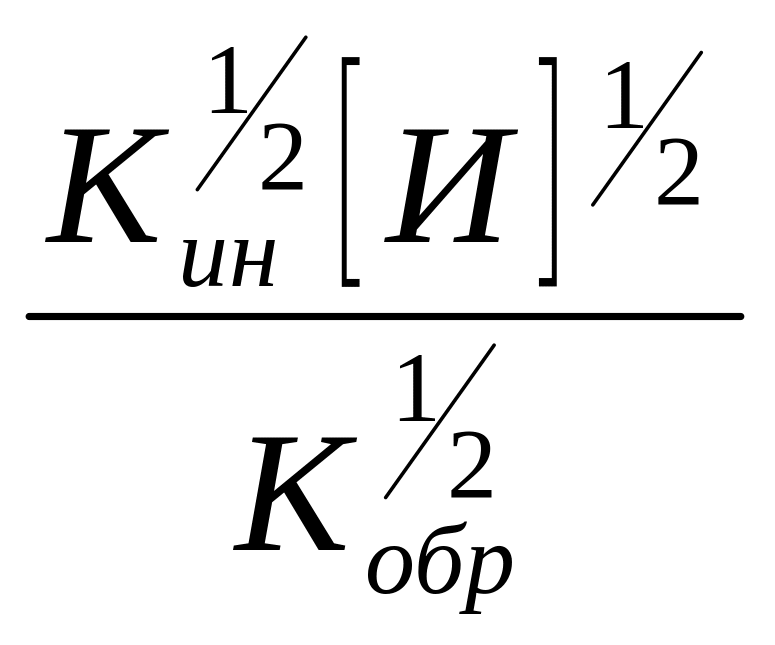 (10)
(10)
Скорость ПМ будет описываться уравнением
W=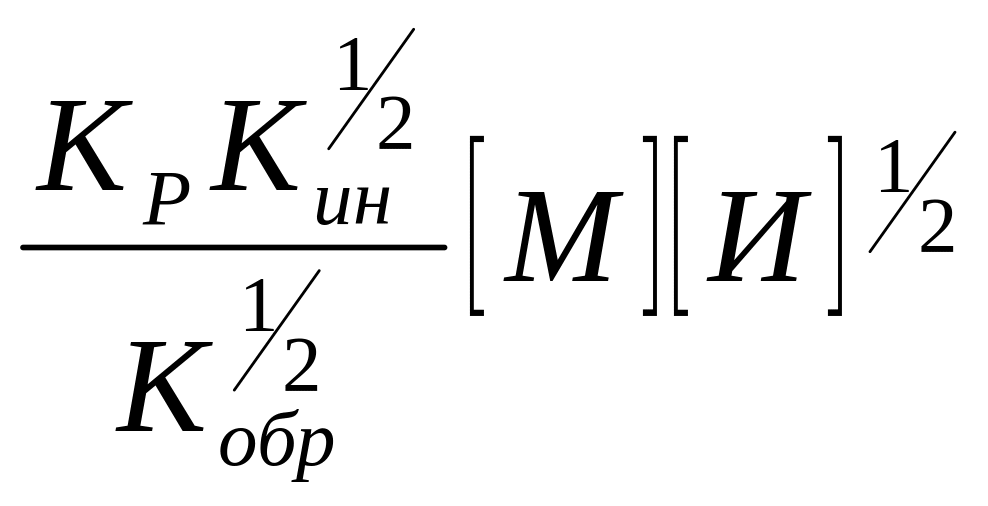 (11)
(11)
В
стационарном состоянии
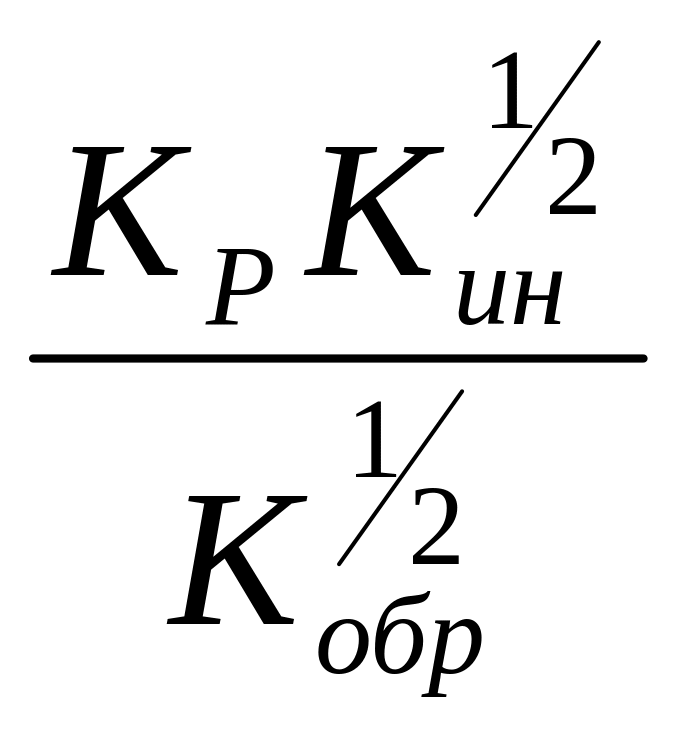 является величиной постоянной, и равна
константе скорости реакции ПМ - К, и
уравнение (11) запишем
является величиной постоянной, и равна
константе скорости реакции ПМ - К, и
уравнение (11) запишем
W=![]() (12)
(12)
Скорость прямо пропорциональна концентрации мономера в первой степени и концентрации инициатора в степени 0,5. Экспериментальные данные подтверждают справедливость этого уравнения.
Наиболее общей закономерностью радикальной ПМ является половинный порядок по инициатору. Это свидетельствует о бимолекулярном обрыве цепей.
Скорость
роста полимерной цепи Wр
представляет собой количество молекул
мономера, присоединяющихся к растущим
полимерным радикалам в единицу времени.
Скорость обрыва цепи Wобр
определяется числом макрорадикалов,
прекращающих рост в результате реакций
обрыва цепи в единицу времени. Следовательно
отношение
![]() показывает сколько молекул мономера
присоединяется к одному растущему
макрорадикалу до момента прекращения
его существования как радикала, т.е. до
момента его перехода в систему с четным
числом электронов (свободный радикал
имеет неспаренный электрон). Это
соотношение носит название длины
кинетической цепи и обозначается .
показывает сколько молекул мономера
присоединяется к одному растущему
макрорадикалу до момента прекращения
его существования как радикала, т.е. до
момента его перехода в систему с четным
числом электронов (свободный радикал
имеет неспаренный электрон). Это
соотношение носит название длины
кинетической цепи и обозначается .
= (13)
Так как в стационарном состоянии Wобр=Wин.,
=![]() .
.
Подставив в уравнения (13) значение Wр и Wобр из уравнений (7, 8).
=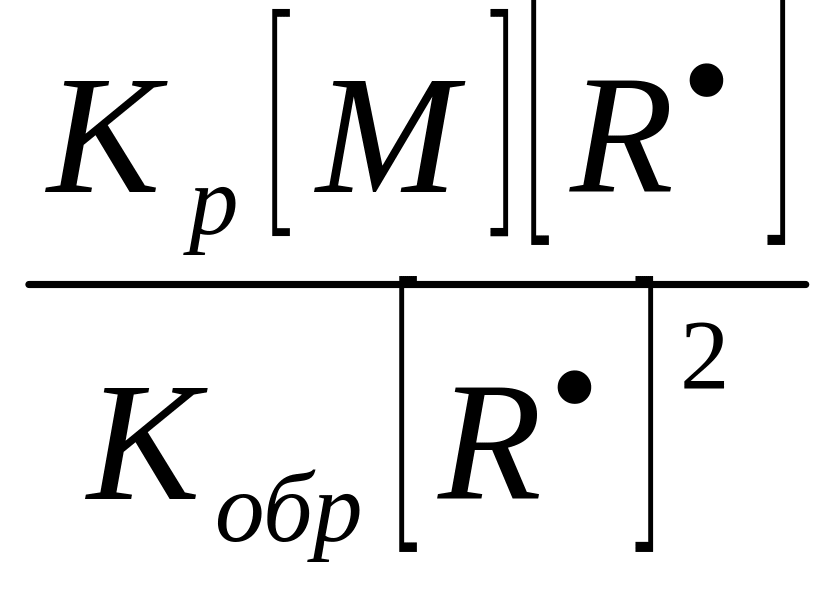 =
=![]() (14)
(14)
Заменив [R] его значением из уравнения (10), получим
=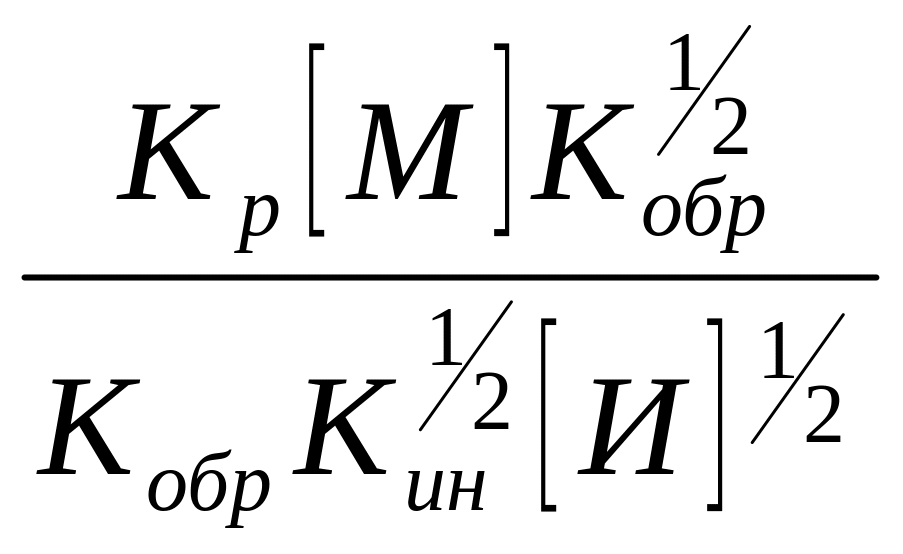 =
=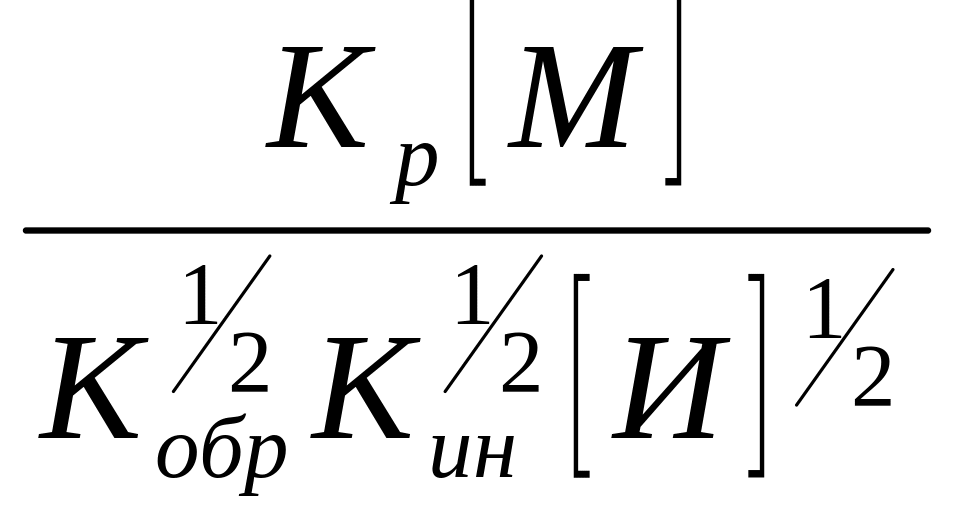 (15)
(15)
Уравнение
15 малопригодно для расчета, т.к. требует
определения частных констант. Преобразуем
уравнение 15, умножив числитель и
знаменатель на
![]()
=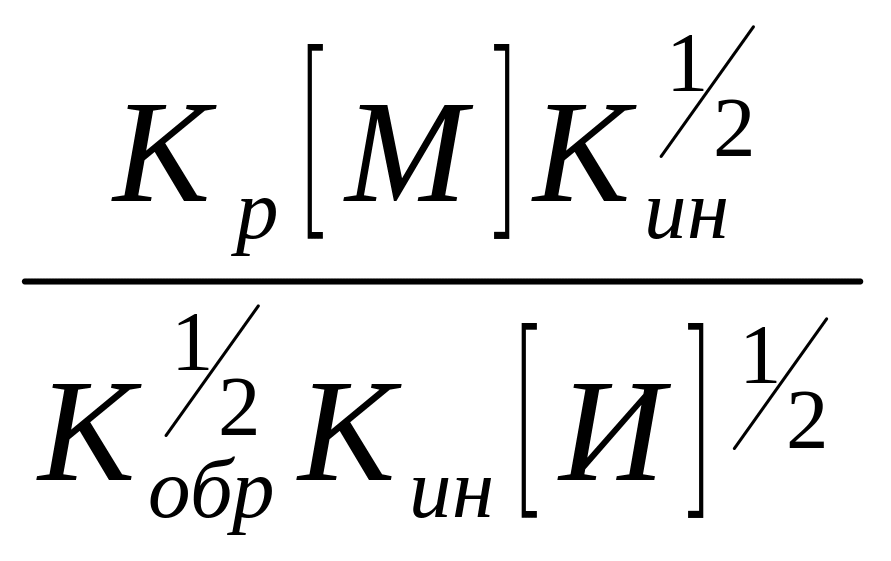 ,
т.к.
=
,
т.к.
=![]() ,
то
,
то
=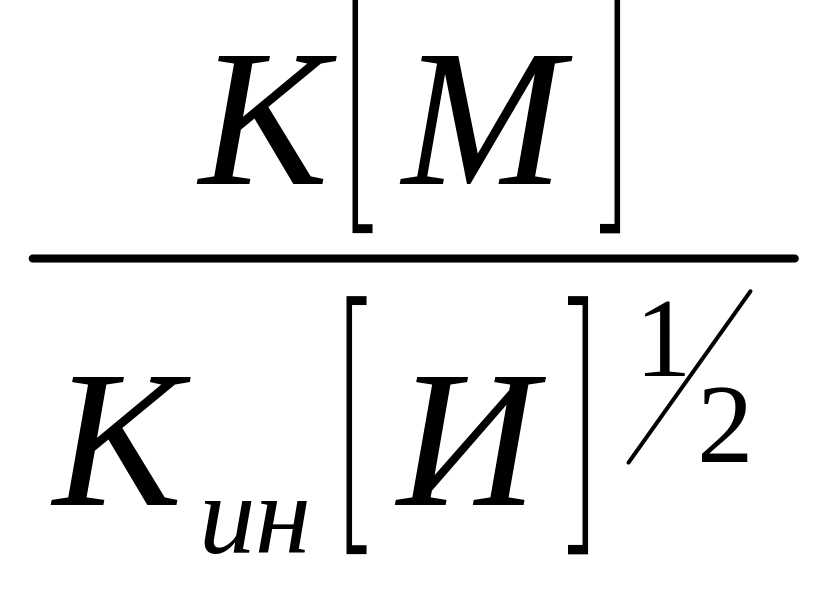 (16)
(16)
В этом уравнении [М] и [И]1/2 известны из условий эксперимента, к находят экспериментально, а величина Кин равна 2Красп*f, значения Красп и f могут быть найдены экспериментальным путем. Следовательно, из уравнения (16) длина кинетической цепи прямо пропорциональна концентрации мономера и обратно пропорциональна корню квадратному из концентрации инициатора.
Если в уравнении (15) числитель и знаменатель умножить на Кр[М], то получим
=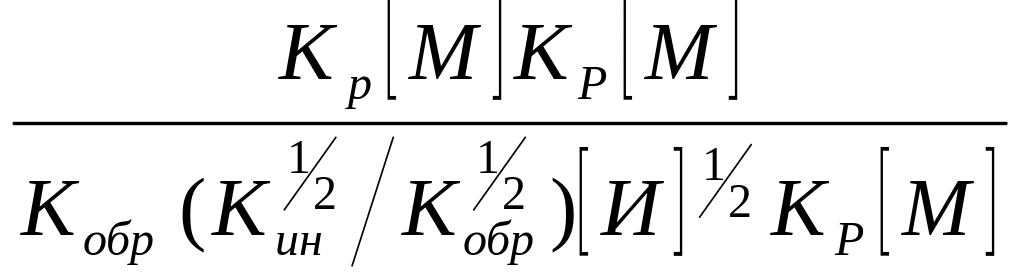 =
=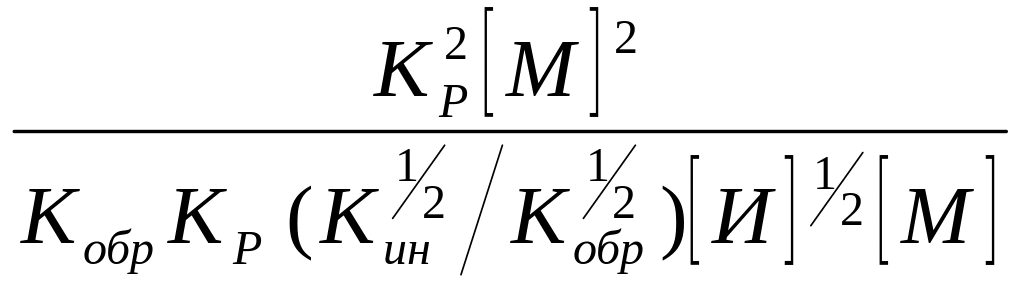
Применим уравнение (11), тогда
=![]()
Видно, что длина кинетической цепи обратно пропорциональна скорости полимеризации.
В тех случаях ,когда обрыв цепи происходит в результате реакции рекомбинации
2RMn-1MRMnMnR
средний
коэффициент полимеризации
![]() образующегося полимера будет равен 2.
При обрыве цепи диспропорционированием
радикалов
образующегося полимера будет равен 2.
При обрыве цепи диспропорционированием
радикалов
2RMn-1M RMn-1M/+ RMn-1M//
средний коэффициент полимеризации будет равен .
Следовательно, в случае обрыва цепи диспропорционированием из уравнения 16
= (18)
а в случае рекомбинации
= (19)
(19)
На начальной стадии полимеризации, когда превращение мономера в полимер невелико, концентрацию мономера можно принять постоянной и тогда из уравнений 18 и 19 видно, что средний коэффициент полимеризации , а следовательно, его ММ обратно пропорциональны корню квадратному из концентрации инициатора. Т.о., изменяя концентрацию инициатора, мы можем менять ММ в желаемом направлении.
Используя уравнение 17 получим для при обрыве цепи диспропорционированием и рекомбинацией макрорадикалов соответственно
=![]() ;
=
;
=![]()
Из уравнений видно, что и ММ обратно пропорциональны скорости полимеризации. Следовательно, ускорение реакции ПМ любым методом будет приводить к уменьшению ММ полимера и наоборот.
Влияние различных факторов на процесс радикальной полимеризации.
Механизм большинства реакций цепной ПМ сложнее, чем рассмотренная схема. Однако, зная общие закономерности, легче понять влияние различных факторов на течение и конкретных реакций цепной ПМ.
Влияние температуры. С повышением температуры скорости отдельных стадий процесса возрастают. Увеличение скорости образования активных центров и реакции роста цепи приводит к возрастанию суммарной скорости процесса превращения мономера в полимер, в то время как, увеличение скорости реакций обрыва цепи, замедляет этот процесс, укорачивает реакционную цепь и снижает ММ образующего полимера. Увеличение скорости роста цепи ведет к удлинению реакционной цепи и повышению ММ полимера.
Реакция образования активных центров протекает с высокой энергией активации; значения энергии активации роста и обрыва цепи значительно меньше и соизмеримы друг с другом. Увеличение скорости элементарных реакций с повышением температуры тем больше, чем выше энергия активации данной реакции. Поэтому относительное повышение скорости образования активных центров с возрастанием температуры значительно превышает относительное изменение скорости реакций роста и обрыва цепи.
Известно, что (уравнение 11)
W=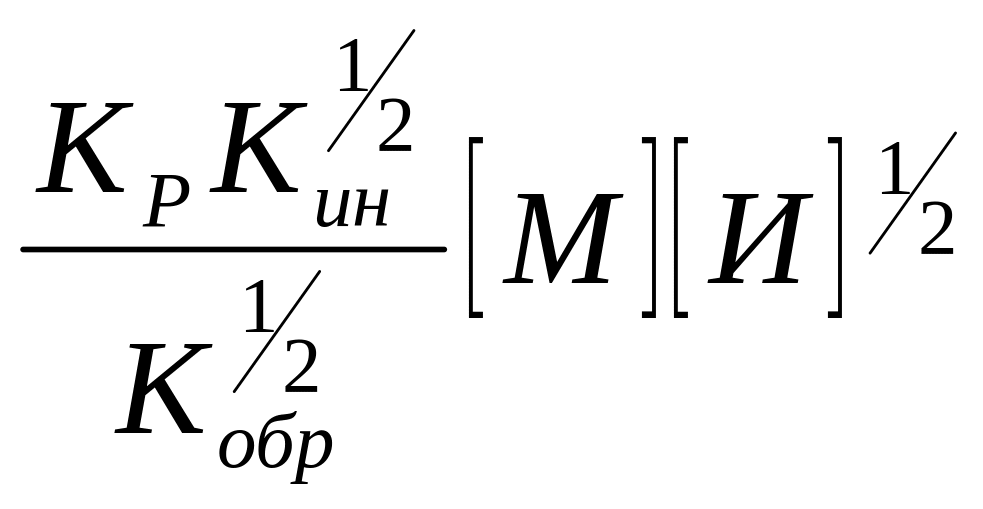 ,
,
Заменив
в этом уравнении
![]() на
на
![]() (уравнение 4)
(уравнение 4)
W=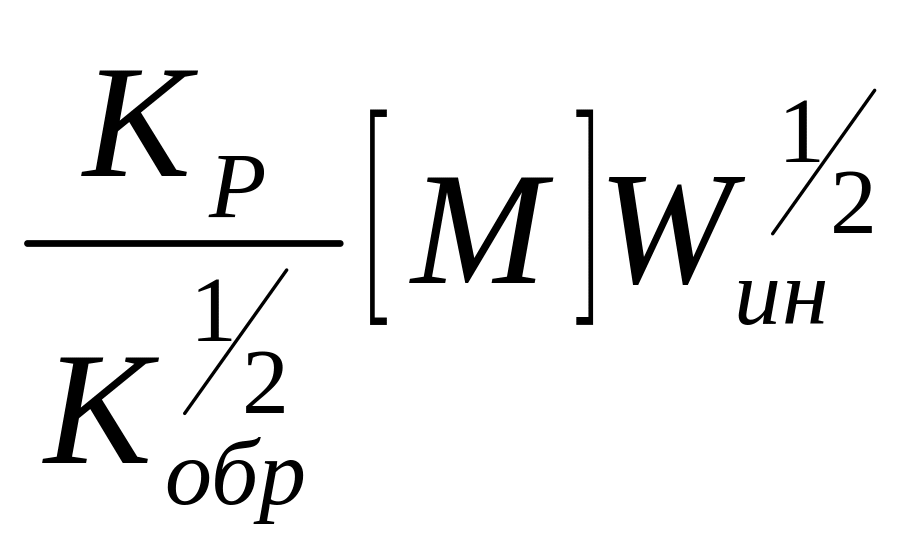
Следовательно, увеличение скорости инициирования приведет к повышению общей скорости ПМ.
С увеличением скорости инициирования, возрастает концентрация свободных радикалов в системе, что приводит к повышению скорости роста цепи и скорости обрыва цепи как следует из уравнений 8 и 9
Wp=Kp[M][R]
Wp=Kобр[R]2
Из уравнений видно, что скорость обрыва цепи с повышением температуры возрастает в большей степени, чем скорость роста цепи, т.к. [R] в уравнении скорости обрыва цепи входит во второй степени.
Средний коэффициент ПМ равен
=![]()
Т.к. скорость обрыва цепи при повышении температуры возрастает быстрее, чем скорость роста цепи, что с повышением температуры средний коэффициент ПМ уменьшается.
В случае фотохимической и реакционной ПМ скорость ПМ мало зависит от температуры, и в основном определяется интенсивностью облучения.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ ИНДИКАТОРА
С повышением концентрации инициатора число свободных радикалов, образующихся при его распаде возрастает, что приводит к увеличению числа активных центров, а следовательно, к возрастанию суммарной скорости ПМ.
ВЛИЯНИЕ ДАВЛЕНИЯ
Повышение давления до нескольких атмосфер и даже нескольких десятков практически не влияет на процесс полимеризации. Применение высоких давлений до нескольких тысяч атмосфер значительно ускоряет процесс ПМ. Например, общая скорость ПМ ММА при 100 С и давлении 700 ат. Возрастает примерно в 6 раз, чем при 100 С и атмосферном давлении. Увеличение скорости ПМ при высоких давлениях наблюдается и для других мономеров. Особенностью ПМ под высоким давлением является то что увеличение скорости реакции не сопровождается уменьшением ММ.
