
- •Типы рестриктаз.
- •Молекулярная основа мутаций. Причины мутаций. Действие физических факторов
- •Молекулярная основа мутаций
- •Мутации концентрируются в горячих точках
- •Мутант ctgg ctgg ctgg ctgg
- •Частота мутирования
- •Причины мутаций
- •Репарация ошибок спаривания (mismatch)
- •Эксцизионная репарация оснований
- •Эксцизионная репарация нуклеотидов
- •Прямая репарация (обращение повреждений днк)
- •Специфические механизмы репарации днк
Прямая репарация (обращение повреждений днк)
Репарация некоторых видов повреждений ДНК может происходить без предварительного удаления измененного основания или нуклеотида. Одним из наиболее полно изученных процессов прямой репарации является так называемая фотореактивация циклобутиловых пиримидиновых димеров, которая осуществляется с участием особого фермента ДНК-фотолиазы. Выше уже указывалось, что образование пиримидиновых димеров индуцируется УФ-светом, в свою очередь, ДНК-фотолиаза используя энергию поглощенного света, обеспечивает обращение данного повреждения (рис. 7). В большинстве случаев активность фотолиаз проявляется в присутствии двух кофакторов, которые выполняют функцию светопоглощающих агентов или, другими словами, хромофоров. Одним из таких хромофоров всегда является FADH¯. Другой хромофор у E. coli и дрожжей представлен фолатом. Характерно, что ферменты фотолиазы не обнаружены у плацентарных животных, отсутствуют они и у человека.
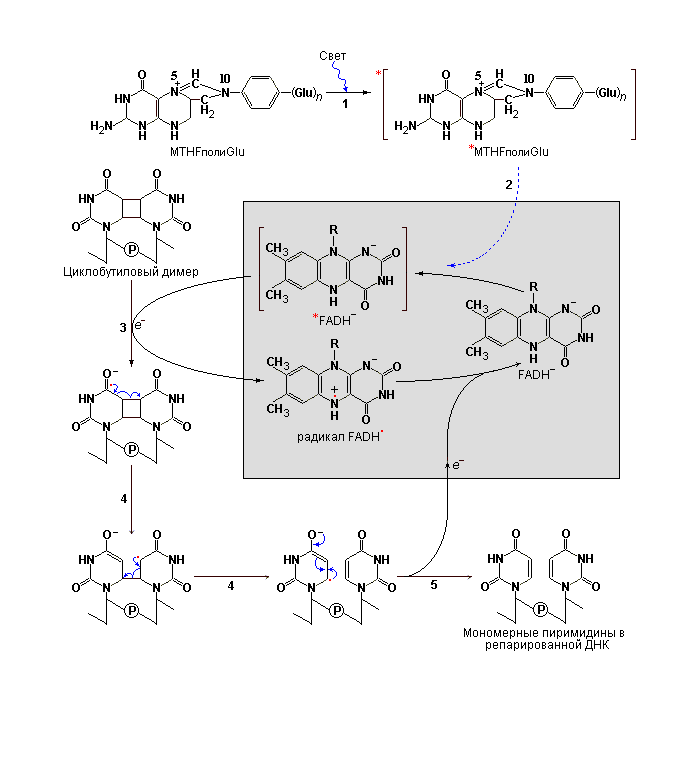
Рис. 7 |
Репарация пиримидиновых димеров с участием ДНК-фотолиазы. ДНК-фотолиазы используют энергию поглощенного света для осуществления обращения повреждения, возникшего при действии УФ-света. ДНК-фотолиаза E. coli (мол. масса 54.000) включает два хромофора представленные N5,N10-метенилтетрагидрофолил-полиглутаминовой кислотой (MTHFpolyGlu) и FADH¯. После связывания фотолиазы с пиримидиновым димером фермент осуществляет процесс репарации протекающий в несколько стадий: 1 – MTHFpolyGlu действуя как фотоприемник поглощает свет с длиной волны от 300 до 500 нм, 2 – энергия возбуждения передается на FADH¯, расположенный в активном центре фермента, 3 – возбужденный флавин (*FADH¯) передает электрон на пиримидиновый димер, который превращается в нестабильный радикал, 4 – перегруппировка электронов в составе димера приводит к разрыву циклобутилового кольца состоящего из атомов углерода С-5 и С-6 двух соседних остатков пиримидинов, а электрон – 5 – переносится обратно на флавин, регенерируя, тем самым, его исходное состояние. |
Механизм реакции фотореактивации в целом включает образование свободных радикалов.
Еще одним примером репарации определенных видов повреждений ДНК, протекающей без предварительного удаления измененного основания или нуклеотида, является прямое исправление ошибок, возникающих в результате действия алкилирующих агентов. Под действием алкилирующих соединений наиболее часто подвергается модифицированию азотистое основание гуанин, енольная форма которого в присутствии, например, диметилсульфата или диметилнитрозамина превращается в О6-метилгуанин. О6-метилгуанин утрачивает способность спариваться с цитозином, но образует пару с тимином, что служит причиной транзиции G-C А-Т. Прямая репарация О6-метилгуанина осуществляется с участием О6-метилгуанин-ДНК-метилтрасферазы – фермента, который катализирует перенос метильной группы от О6-метилгуанина на сульфгидрильную группу одного из собственных остатков цистеина. Строго говоря, данная метилтрансфераза не является ферментом в общепринятом смысле этого слова, поскольку процесс метилирования одного из остатков цистеина этого белка неизбежно приводит к его полной инактивации. Таким образом, «расходование» целой молекулы белка с единственной целью – исправить одно поврежденное основание служит дополнительным доказательством приоритетности сохранения целостности ДНК.
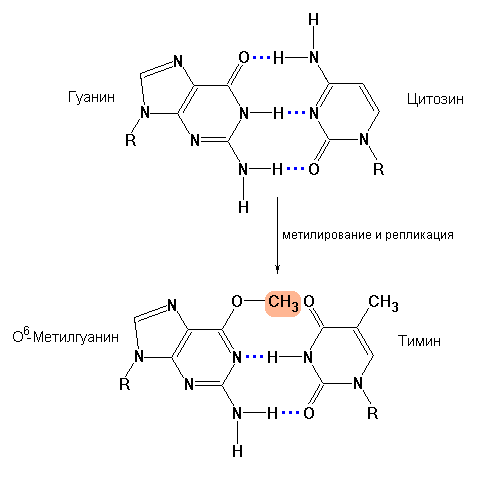
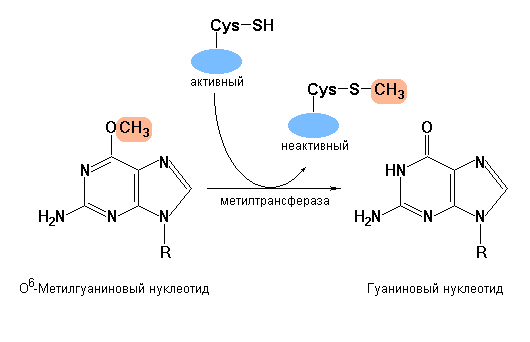
Рис. 8 |
Схема, показывающая изменение характера спаривания гуанина в результате его О6-метилирования. (а) – О6-метилгуанин утрачивает способность спариваться с цитозином, но образует пару с тимином. В случае не исправления данной модификации гуанина ферментами репарации ДНК, последующая репликация измененного сайта этой информационной молекулы приведет к появлению транзиции G-C А-Т и, соответственно, к мутации. (b) – репарация О6-метилгуанина осуществляется с участием О6-метилгуанин-ДНК-метилтрасферазы, которая катализирует перенос метильной группы от О6-метилгуанина на сульфгидрильную группу одного из собственных остатков цистеина. При этом белок инактивируется. |
Отличный от выше описанного, но в такой же степени прямой механизм используется для репарации 1-метиладенина и 3-метилцитозина. Аминогруппы остатков аденина и цитозина подвергаются метилированию реже, чем енольная форма гуанина, причем модифицируются эти основания, главным образом, в составе одно-цепочечных участков ДНК. Модификация аминогрупп остатков аденина и цитозина, также как и в случае О6-метилгуанина, приводит к изменению характера спаривания этих оснований. Известно, что у E. coli репарация 1-метиладенина и 3-метилцитозина осуществляется в ходе реакции окислительного деметилирования, катализируемой белком AlkB – -кетоглутарат-Fe2+-зависимой диоксигеназой, являющимся представителем надсемейства диоксигеназ.

Рис. 9 |
Прямая репарация алкилированных оснований с участием белка AlkB. AlkB представляет собой -кетоглутарат-Fe2+-зависимую диоксигеназу, которая катализирует окислительное деметилирование 1-метиладенина и 3-метилцитозина. |
