
- •Типы рестриктаз.
- •Молекулярная основа мутаций. Причины мутаций. Действие физических факторов
- •Молекулярная основа мутаций
- •Мутации концентрируются в горячих точках
- •Мутант ctgg ctgg ctgg ctgg
- •Частота мутирования
- •Причины мутаций
- •Репарация ошибок спаривания (mismatch)
- •Эксцизионная репарация оснований
- •Эксцизионная репарация нуклеотидов
- •Прямая репарация (обращение повреждений днк)
- •Специфические механизмы репарации днк
Специфические механизмы репарации днк
Процессы репарации ДНК, рассматривавшиеся до этого момента, касались исправления ошибок в составе двухцепочечной ДНК, где неповрежденная цепь предоставляет верную генетическую информацию для правильного исправления другой – поврежденной цепи. Однако при некоторых типах повреждений, таких как двухцепочечные разрывы, межцепочечные сшивки или при повреждениях одноцепочечной ДНК (как, например, в случае генома фага Х174), комплементарная цепь сама оказывается поврежденной или вообще отсутствует. Чаще всего двухцепочечные разрывы или повреждения в одноцепочечной ДНК возникают тогда, когда движущаяся репликативная вилка наталкивается на не исправленное по какой-либо причине повреждение в ДНК. Подобного рода повреждения, а также образование межцепочечных сшивок могут также возникать в результате действия ионизирующего излучения на генетический материал клетки или в ходе реакций окисления структурных компонентов ДНК.
В настоящее время установлено, что бактериальные клетки в случае «застревания» или временной остановки репликативной вилки в каком-либо участке ДНК, содержащем не исправленное повреждение, используют два способа репарации.
Первый способ, при отсутствии второй (комплементарной) цепи необходимой для точной репарации, связан с возможностью предоставления генетической информации, источником которой является отдельная гомологичная хромосома. Из этого следует, что в данном случае система репарации зависит от общей гомологической рекомбинации. Более детально процесс такой рекомбинационной репарации будет рассматриваться позже.
В некоторых условиях используется второй путь репарации, который называют независимым от повреждения синтезом ДНК (error-prone translesion DNA synthesis) (TLS). При активации данного способа исправления ошибок, процесс репарации ДНК становится значительно менее точным и сохраняется высокая вероятность мутирования. У бактерий TLS-репарация является частью общего механизма ответа клетки на обширные повреждения ДНК, вызванные различными химическими или физическими факторами. Этот общий механизм весьма удачно назван SOS-ответом. Некоторые белки участвующие в SOS-ответе, такие как уже упоминавшиеся ранее uvrA и uvrB, в норме всегда присутствуют в клетке, однако их уровень резко возрастает при серьезных повреждениях ДНК и, соответственно, в результате активации процесса SOS-репарации. В TLS-репарации ДНК дополнительно принимают участие специфические SOS-белки, известные как UmuC и UmuD (о важной роли белков UmuC и UmuD говорит тот факт, что инактивация генов umu приводит к полному нарушению процесса TLS-репарации).
Белок UmuD в ходе SOS-регулируемого процесса подвергается специфическому протеолитическому расщеплению с образованием своей укороченной формы UmuD/. Впоследствии укороченная форма UmuD/ образует с белком UmuC комплекс, который представляет собой специализированную ДНК-полимеразу, известную как ДНК-полимераза V. Эта ДНК-полимераза способна реплицировать такие поврежденные участки в ДНК, на которых в норме репликативная вилка «застревала бы» или делала временную остановку. Поскольку в таких случаях правильного спаривания оснований в сайтах повреждения не происходит, подобная репликация сама по себе несет множество ошибок (error-prone).
Может показаться, на первый взгляд, что существование и функционирование системы репарации включающей ДНК-полимеразу V, которая только увеличивает частоту мутаций, не соответствует целям сохранности генетической информации. Более того, можно думать, что такая система репарации включается в момент полной безысходности для жизни клетки. Однако не все так просто. Гены, ответственные за синтез белков UmuD и UmuC активируются только на поздних этапах SOS-ответа и они абсолютно не активны в тех случаях, когда повреждения ДНК не являются настолько масштабными, что продвижение репликативной вилки постоянно блокируется. Накопление мутаций, вызванное функционированием ДНК-полимеразы V, убивает одни клетки и создает большую опасность для жизни других, но такова биологическая цена для многоклеточного организма, которую он платит за преодоление «непреодолимого» барьера для репликации, поскольку при этом создаются условия для выживания, по крайней мере, части мутантных клеток.
Функционирование ДНК-полимеразы V зависит от участия некоторых других важных белков клетки, таких как белка RecA, SSB-белков, а также некоторых субъединиц ДНК-полимеразы III. Еще одна ДНК-полимераза – ДНК-полимераза IV также индуцируется в ходе SOS-ответа. Процесс репликации, осуществляемый ДНК-полимеразой IV (продуктом гена DinB), как и в случае ДНК-полимеразы V также сопровождается сохранением ошибок в ДНК. В целом бактериальные ДНК-полимеразы IV и V являются представителями семейства TLS-полимераз обнаруживаемых и в клетках других организмов. Эти ферменты в ходе эволюции утратили корректирующую 3/-экзонуклеазную активность, что снижает точность (селективность) выбора соответствующего нуклеотида при репликации ДНК с участием этих ДНК-полимераз на величину, составляющую 102. Другими словами точность репликации с участием ДНК-полимераз IV и V уменьшается до 1 ошибки на ~1000 нуклеотидов.
У млекопитающих также обнаружено множество ДНК-полимераз семейства TLS, отличающихся низкой точностью копирования. Однако функционирование этих ферментов не является вредоносным для клетки, поскольку они принимают участие только в процессах репарации ДНК. Например, ДНК-полимераза (эта), обнаруженная у всех эукариот, принадлежит к семейству TLS-полимераз. Этот фермент обеспечивает репликацию ДНК, не принимая во внимание присутствия в одной из матричных цепей циклобутилового димера (т.е. пиримидинового димера). В этом случае может даже происходить встраивание двух адениновых нуклеотидов комплементарных циклобутиловому димеру. Некоторые другие, не корректирующие ДНК-полимеразы, такие как ДНК-полимеразы , (йота) и принимают участие в специфических реакциях эксцизионной репарации оснований у эукариот. Интересно, что каждый из этих ферментов обладает необычной 5/-дезоксифосфат-лиазной активностью в дополнение к своей обычной полимеразной активности. После удаления неправильного основания под действием гликозилазы и последующего расщепления сахарофосфатного остова с участием АР-эндонуклеазы эти ферменты удаляют 5/-дезоксифосфатную группу в сайте лишенном основания и заполняют этот небольшой пробел за счет своей полимеразной активности. Частота возникновения мутаций обусловленная действием ДНК-полимеразы сводится к минимуму из-за небольшой протяженности участка (часто всего в один нуклеотид) псевдорепарирования с участием этого фермента.
Репарация, включающая рекомбинацию
Как указывалось выше, исправление повреждений ДНК может осуществляться с участием особых ферментов рекомбинационной репарации, которые используют материал одной молекулы ДНК для восстановления другой молекулы. Название этого способа исправления повреждений свидетельствует о перекрывании процесса репарации с процессом общей генетической рекомбинации. Поэтому для рекомбинационной репарации необходимо, чтобы поврежденная ДНК имела реплику (т.е. дочернюю ДНК), в связи с этим ее иногда называют пострепликативной репарацией. Данный способ исправления ошибок эффективен в случае появления дефектов, образуемых в дочерних цепях при репликации матрицы, содержащей поврежденные основания.
Рассмотрим функционирование системы рекомбинационной репарации на примере удаления поврежденного участка, содержащего тиминовый димер, который по какой-либо причине не был удален одним из, описанных способов эксцизионной репарации или фотореактивации. При репликации поврежденный сайт (тиминовый димер) не может служить матрицей, направляющей синтез дочерней цепи. Репликативная машина пропускает этот димер, оставляя в дочерней цепи брешь. Репликация может возобновиться только на некотором расстоянии от димера дальше по цепи – например, в следующем сайте инициации фрагмента Оказаки. Поэтому брешь, оставляемая в дочерней цепи, может оказаться существенной. Образующиеся после репликации молекулы ДНК различны – одна содержит родительскую поврежденную цепь и дочернюю цепь с брешью, вторая содержит неповрежденную родительскую цепь и нормальную комплементарную ей дочернюю цепь.
В результате рекомбинационной репарации брешь напротив поврежденного участка первой молекулы ДНК застраивается при использовании отдельной гомологичной цепи другой молекулы ДНК. Образующаяся в результате такого одноцепочечного обмена молекула содержит родительскую (по-прежнему поврежденную) цепь, спаренную с нормальной дочерней цепью. Вторая молекула ДНК содержит нормальную родительскую цепь с комплементарной дочерней цепью, но уже имеющей брешь, которая застраивается в результате репарирующего синтеза. Таким образом, повреждение в молекуле ДНК сохраняется и события рекомбинационной репарации будут повторяться при каждом акте репликации до тех пор, пока повреждение не будет удалено системой эксцизионной репарации.
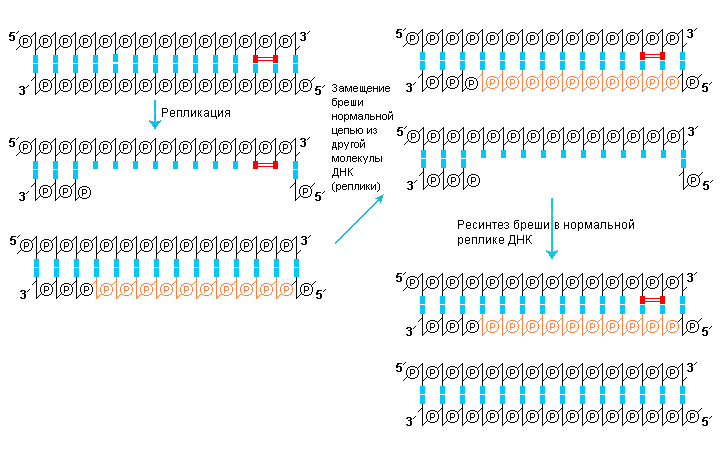
Рис. 10 |
Рекомбинационная репарация молекулы ДНК, содержащей тиминовый димер (показан красным цветом) восстанавливает дочернюю цепь ДНК, замещая оставленную в ней брешь, напротив сайта не исправленным повреждением. |
Изучение более тонких механизмов рекомбинационной репарации оказалось возможным после установления того факта, что в результате мутаций гена recA у E. coli практически полностью нарушается процесс генетической рекомбинации, а также способность к рекомбинационной репарации. Было показано, что в процессы рекомбинационной репарации и общей генетической рекомбинации включаются одни и те же компоненты (хотя набор этих компонентов не полностью идентичен для данных двух механизмов).
Одним из ключевых компонентов рекомбинационной репарации является продукт экспрессии гена recA - белок RecA, который принимает участие в обмене цепями между молекулами ДНК. Прямое участие RecA-белка в рекомбинационной репарации представляет собой только одну из его активностей. Этот интересный белок имеет также другую важную функцию. Он проявляет протеазную активность, индуцируемую УФ-светом или другими воздействиями, способными блокировать репликацию. Эта протеазная активность RecA-белка ответственна за индукцию экспрессии многих генов, чьи белковые продукты также имеют репарирующие функции, например, принимают участие в эксцизионной репарации. Следовательно, белок RecA принимает участие не только в функционировании рекомбинационной репарации, но необходим также для индукции белков эксцизионной репарации.
SOS-репарация
Появление многочисленных и различных по своей природе повреждений в бактериальной хромосоме служит тем пусковым сигналом, который обеспечивает индукцию множества расположенных на значительных расстояниях друг от друга генов. Можно утверждать, что такой ответ клетки, названный SOS-ответом, является замечательным примером координированной регуляции экспрессии генов. При этом происходит включение именно тех генов, которые обеспечивают образование в клетке ферментов ответственных за процесс репарации ДНК. Гены и их белковые продукты, которые участвуют в репарировании разнообразных повреждений в хромосоме E. coli при SOS-ответе, приведены в таблице 1.
Таблица 1
Гены и их белковые продукты, которые участвуют в SOS-ответе у E. coli
|
|
Обозначение гена |
Белок и его функция в SOS-репарации ДНК |
Гены с известной функцией |
|
polB (dinA) |
Кодирует полимеризующую субъединицу ДНК-полимеразы II, необходимую для рестарта репликации при рекомбинационной репарации ДНК |
uvrA uvrB |
Кодируют субъединицы uvrA и uvrB нуклеазы ABC, участвующей в эксцизионной репарации (главным образом, тиминовых димеров) |
umu C umu D |
Кодируют ДНК-полимеразу V |
sulA |
Кодирует белок, тормозящий клеточное деление, что позволяет клетке осуществить репарацию ДНК |
recA |
Кодирует белок recA, участвующий в общей рекомбинации, рекомбинационной и SOS репарации |
dinB |
Кодирует ДНК-полимеразу IV |
Гены, участвующие в ДНК-зависимых процессах, но их роль в репарации ДНК не установлена |
|
ssb |
Кодирует ssb-белки |
uvrD |
Кодирует ДНК-геликазу II |
himA |
Кодирует одну из субъединиц фактора интеграции хозяина (IHF), участвующего в сайт-специфической рекомбинации, репликации, транспозиции и регуляции экспрессии генов |
recN |
Участвует в рекомбинационной репарации |
Гены с неизвестной функцией |
|
dinD |
|
dinF |
|
Ключевыми белками, участвующими в SOS-репарации являются белок RecA и репрессор LexA. Репрессор LexA (белок с молекулярной массой 22.700) ингибирует транскрипцию всех SOS-генов (см. табл. 1), поэтому вполне понятно, что индукция SOS-ответа требует удаления белка LexA. При этом речь идет не простой диссоциации белка LexA из комплекса с ДНК в ответ на связывание определенной малой молекулы с этим репрессором, как это имеет место в случае регуляции активности, например, lac-оперона. Вместо этого белок LexA инактивируется путем автокаталитического расщепления пептидной связи между остатками Gly-Ala, распадаясь на два, грубо говоря, равных пептидных фрагмента. При физиологических условиях, в том числе физиологических значениях рН, данная реакция автокатализа требует участия белка RecA. Белок RecA не является протеазой в классическом понимании, но его взаимодействие с LexA облегчает протекание реакции автокаталитической инактивации LexA. Такую функцию белка RecA иногда называют копротеазной активностью.
Таким образом, белок RecA обеспечивает специфическую функциональную связь между биологическим сигналом (представляющим собой повреждение ДНК) и процессом индукции SOS-генов. Серьезные повреждения ДНК приводят к появлению многочисленных одноцепочечных участков (брешей) и только белок RecA благодаря своей способности взаимодействовать с одноцепочечной ДНК может облегчить саморасщепление репрессора LexA. Итак, в целом связывание RecA с одноцепочечной брешью сначала приводит к проявлению его собственной копротеазной активности, затем активный RecA способствует расщеплению LexA, что, в конечном итоге, проявляется в индукции SOS-ответа.
При индукции SOS-генов в сильно поврежденных клетках RecA сам по себе начинает проявлять протеазную активность и тем самым инактивировать молекулы репрессоров, которые в норме препятствуют размножению некоторых вирусов присутствующих в бактериальной клетке в лизогенном состоянии. Такие репрессоры, подобно LexA, инактивируются путем автокаталитического расщепления пептидной связи между остатками Gly-Ala, так что индукция SOS-генов может сопровождаться репликацией вирусной ДНК, лизисом клетки и высвобождением вирусного потомства. Это означает, что бактериофаг получает возможность быстро покинуть клетку-хозяина, находящуюся в большой опасности.

Рис. 11 |
Реализация SOS-ответа в клетках E. coli. В табл. 1 приведены данные о функции ряда белков участвующих в SOS-ответе. Белок LexA является репрессором всей системы SOS-ответа, который взаимодействует с операторами (показаны красным цветом) всех SOS-генов. Поскольку ген recA не полностью репрессируется белком LexA, в любой момент времени в клетке присутствует около 1.000 копий мономеров белка RecA. 1 – При обширных повреждениях ДНК (например, при действии УФ-света) репликация этой информационной молекулы приостанавливается в результате появления целой серии одноцепочечных брешей. 2 – Белок RecA связывается с одноцепочечными участками ДНК и такое взаимодействие обеспечивает приобретение белком RecA дополнительной – протеолитической активности. 3 – RecA-протеаза расщепляет и, тем самым, инактивирует репрессор LexA. В результате инактивации репрессора LexA происходит индукция SOS-генов, включая индукцию гена recA, при этом концентрация белка RecA в клетке возрастает в 50-100 раз. |
SOS-репарация (SOS-ответ)
Многие воздействия, которые повреждают ДНК или ингибируют ее репликацию у E. coli вызывают индукцию целой серии фенотипических изменений, получивших название SOS-ответа. Часто какое-нибудь резкое воздействие среды активирует целый набор именно тех генов, продукты которых способны защитить клетки от этого воздействия. Всем клеткам присущ, например, такой механизм, как реакция на тепловой шок; ее можно наблюдать в клетках, подвергшихся действию чрезмерно высоких температур. При этом индуцируется синтез особых «шоковых» белков, часть которых, по-видимому, помогает стабилизировать и репарировать другие клеточные белки, частично денатурированные тепловым шоком.
Во многих клетках существуют также механизмы, дающие им возможность синтезировать ферменты, необходимые для репарации ДНК в «аварийных» ситуациях.
Начало такого ответа определяется взаимодействием белка RecA с другим белком – LexA, который выполняет функцию репрессора многих оперонов. Ответ клетки, выражающийся в увеличенной способности репарировать поврежденную ДНК, достигается путем индукции синтеза многочисленных компонентов системы эксцизионной репарации и RecA-зависимой репарации.
Ответ клетки на повреждающее воздействие начинается с активации протеазной активности белка RecA. В настоящее время очень мало известно относительно пускового механизма, который обеспечивает проявление протеазной активности RecA-белком. Однако большинство исследователей склоняется к мысли, что таким пусковым механизмом является появление протяженных участков одноцепочечной ДНК. Активированная RecA-протеаза расщепляет белок-репрессор LexA, что приводит к координированной индукции многих оперонов. Как было показано, протеаза RecА гидролизует в LexА пептидную связь Ala-Gly, локализованную в середине полипептидной цепи. В результате генетических и биохимических исследований механизма SOS-ответа были выявлены неиндуцируемые мутанты lexA – , у которых в белке LexА присутствовала негидролизуемая пептидная связь Ala-Asp.
Некоторые из SOS-генов активируются только после повреждающих воздействий, другие активны в норме, но уровень их экспрессии существенно возрастает при разрезании LexA-репрессора. Например, ген uvrB, который является компонентом системы эксцизионной репарации, имеет два промотора, но только один из них находится под контролем LexA. Именно по этой причине после разрезания репрессора происходит увеличение экспрессии гена uvrB.
Очистка LexA позволила охарактеризовать механизм его действия in vitro. Данный белок связывается с последовательностью ДНК длиной около 20 пар оснований, названной SOS-блоком. Эта последовательность, представляющая собой палиндром, присутствует в каждом локусе-мишени. SOS-блоки различных локусов не полностью идентичны, но всегда представлены последовательностями, с восемью абсолютно одинаковыми парами оснований. Подобно другим операторам, SOS-блоки перекрываются с последовательностями соответствующих промоторов (см. главы «Транскрипция» и «Контроль генной экспрессии у прокариот»).
Функции RecA и LexA являются взаимоисключающими в SOS-цикле. RecA разрезает LexA, который в свою очередь, в норме репрессирует синтез RecA. SOS-ответ вызывает амплификацию обоих белков и результаты этой амплификации не столь противоречивы, как может показаться на первый взгляд.
Очевидно, что в клетке гены recA и lexA лишь частично репрессированы LexA-репрессором. Увеличение синтеза RecA необходимо для осуществления рекомбинационной репарации. А это, в свою очередь, приводит к проявлению протеазной активности RecA и разрезанию имеющегося репрессора LexA.
Прекращение действия индуцирующего сигнала вызывает потерю протеазной активности белком RecA. Однако к этому моменту ген lexA имеет очень высокий уровень экспрессии, поэтому при потере RecA-белком своей протеазной активности в клетке быстро накапливается необходимое количество активного LexA-репрессора, что приводит к выключению SOS-ответа. Именно такими взаимоотношениями белков RecA и LexA можно объяснить легкую обратимость SOS-ответа в клетке.
Протеаза RecA обладает способностью действовать и на некоторые другие репрессорные белки, например, репрессоры отдельных профагов. Именно на примере репрессора профага лямбда была открыта протеазная активность RecA. Это объясняет причину индукции профага лямбда под действием УФ-света – RecA разрезает лизогенный репрессор и фаг включается в литический цикл развития. Указанная реакция не является клеточным SOS-ответом, она лишь свидетельствует о способности профага узнавать, что клетка находится в опасности, и обеспечивать его выживаемость вступлением в литический цикл.
