
Отчеты по лабораторным работам / лаба 8 / лаба 8
.docЦель работы:
-
провести опыты по химической и электрохимической коррозии;
-
научиться определять анод и катод коррозионной гальванопары;
-
изучить методы защиты металлов от коррозии.
Теоретическая часть:
-
Химическая коррозия – это процесс самопроизвольного разрушения металлов за счет прямого взаимодействия их с токонепроводящей внешней средой (газ, жидкий неэлектролит).
Электрохимическая коррозия – это разрушение металла в результате электрохимического взаимодействия с электролитами.
-
Основным признаком химической коррозии является то, что она происходит без возникновения в системе электрического тока.
Электрохимическая коррозия протекает на поверхности металлов под действием электрических токов, т.е. наряду с окислительными процессами, характеризующимися отдачей электронов, протекают и чисто электрические процессы – перенос электронов в результате образования гальванических микроэлементов вследствие дифференциации поверхности на катодные и анодные участки.
-
Оксидирование – преднамеренное окисление поверхностного слоя металлических изделий. Образующиеся в результате оксидирования окисные пленки предохраняют изделия от коррозии, имеют декоративное значение, служат в качестве электроизоляции, являются основой для нанесения на них защитных покрытий — лака, краски, жировой смазки и т.д. Оксидирование осуществляется химическим (в воздухе или жидкой среде — щелочах, кислотах) или электрохимическим (анодирование) методами. В зависимости от режима оксидирование и состава сплава получают окисные плёнки толщиной от долей микрона до 500—600 мкм. Оксидированию подвергают изделия из стали, чугуна, алюминиевых, медных, цинковых и др. сплавов.
-
Ингибирование – замедление коррозии при помощи ингибиторов.
Ингибиторы химические, вещества, тормозящие разнообразные химические реакции; находят широкое применение для предотвращения или замедления нежелательных процессов, например коррозионного разрушения металлов, окисления топлив, смазочных масел и пищевых продуктов, полимеризации, старения полимеров
Практическая часть:
Опыт I: Коррозия натрия на воздухе.
Кусочек натрия разрезаем и обращаем внимание на блестящую поверхность свежего среза металла. Через некоторое время наблюдаем потускнение поверхности среза. Металлический натрий очень быстро взаимодействует с кислородом воздуха, при этом образуется оксидная пленка.
2Na + O2 → Na2O2

2 Na0 – e → Na+
1 O2 + 2e → O2 2-
Вывод: Окисление натрия происходит в месте контакта металла с окислителем. Продукт коррозии перекись натрия.
Опыт II: Электрохимическая коррозия оцинкованного и луженного железа.
Проводим качественную реакцию на ионы железа двухвалентного.
3FeSO4 + 2K3[Fe(CN6)] → Fe3[Fe(CN)6]2 + 3K2SO4
3Fe2+ + 2[Fe(CN6)]3- → Fe3[Fe(CN)6]2
Приготовим в двух пробирках растворы электролита:
H2O + K3[Fe(CN6)] + H2SO4
В приготовленные растворы опустим две гальванопары.
Fe/Sn – наблюдаем характерное окрашивание для Fe2+;
Fe/Zn – не наблюдаем характерного окрашивания.
Механизм коррозионного процесса:
1. Fe/Sn
![]() =
-0,32 В (А) Fe0
– 2e
→ Fe2+
=
-0,32 В (А) Fe0
– 2e
→ Fe2+
![]() =
-0,25 В (К) 2H+
+ 2e
→ H20
=
-0,25 В (К) 2H+
+ 2e
→ H20
Р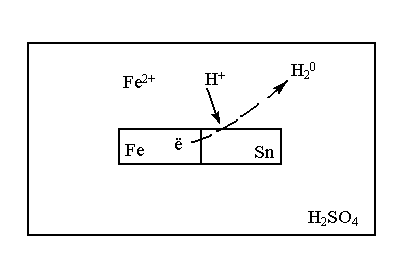 оль
анода выполняет металл с меньшим
электродным потенциалом, т.е. Fe.
оль
анода выполняет металл с меньшим
электродным потенциалом, т.е. Fe.
Схема электрохимической коррозии:
Электроны движутся от Fe к Sn, в растворе движутся ионы. В результате, кроме первичных реакции, на электродах в растворе протекают вторичные реакции.
3Fe2+ + 2[Fe(CN6)]3- → Fe3[Fe(CN)6]2
При местном нарушении защитного покрытия олова происходит разрушение железа как металла имеющего меньший потенциал.
2. Fe/Zn
![]() =
-0,32 В (К)
2H+
+ 2e → H20
=
-0,32 В (К)
2H+
+ 2e → H20
![]() =
-0,84 В (А) Zn0
– 2e
→ Zn2+
=
-0,84 В (А) Zn0
– 2e
→ Zn2+
Р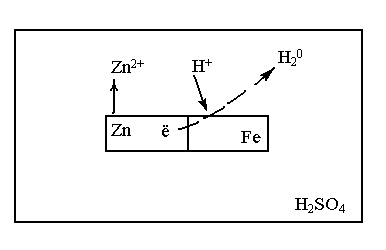 оль
анода выполняет металл с меньшим
потенциалом, т.е. Zn.
оль
анода выполняет металл с меньшим
потенциалом, т.е. Zn.
В раствор переходят ионы Zn и идет вторичная реакция
3Zn2+ + [Fe(CN6)]3- → Zn3[Fe(CN6)]2
Т.к. в растворе нет ионов Fe2+, то и не образуется турнбулевая синь.
При местном нарушении покрытия из Zn будет происходить растворение Zn, т.к. его потенциал меньше.
Вывод: Электрохимическая коррозия в отличие от химической протекает по стадиям: анодные и катодные процессы; движение электронов и ионов, т.е. сопровождается возникновением электрического тока.
Опыт III: Действие ингибитора на коррозию Zn.
В две пробирки с соляной кислотой опускаем по кусочку Zn.
2HCl + Zn → ZnCl2 + H2↑
Zn0 – 2e → Zn2+
2H+ + 2e → H2↑
Когда выделение водорода станет интенсивным добавляем уротропин. Наблюдаем уменьшение интенсивности выделения водорода в пробирке с уротропином.
Вывод: Уротропин выполняет роль ингибитора и замедляет растворение цинка.
