
ПМ Хирургия
.pdf
‘6 (91) ноябрь 2015 г. |
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
|
31 |
|
|||
|
|
|
|
|
|
|
|
Таблица 2.
Сравнительный анализ по видам осложнений в различные периоды деятельности
Виды осложнений |
Первый |
Второй |
Третий |
Всего |
|
период |
период |
период |
|||
|
|
||||
|
|
|
|
|
|
Кровотечение из папиллотомического разреза |
1 (0.7%) |
1 (0.28%) |
0 |
2 (0.19%) |
|
Острый панкреатит, панкреонекроз |
5 (3.8%) |
6 (1.7%) |
3 (0.5%) |
14 (1.4%) |
|
Ретродуоденальная перфорация |
1 (0.7%) |
1 (0.28%) |
0 |
2 (0.19%) |
|
Холангит |
1 (0.7%) |
2 (0.56%) |
1 (0.18%) |
4 (0.38%) |
|
Перфорация холедоха |
0 |
1 |
0 |
1(0.09%) |
|
Миграция стента в холедох |
0 |
3 (0.85%) |
2 (0.36%) |
5 (0.48%) |
|
Синдром Маллори — Вейсса |
0 |
0 |
1 (0.18%) |
1(0.09%) |
|
Острая сердечно-сосудистая недостаточность |
1 (0.7%) |
0 |
0 |
1(0.09%) |
|
Острое нарушение мозгового кровообращения |
0 |
1 (0.28%) |
0 |
1(0.09%) |
Для проведения сравнительного анализа различных видов осложнений после транспапиллярных вмешательств выделили три периода деятельности (табл. 2):
–первый (начальный) с 2007-го по 2008 год. За этот период выполнено 129 операций, диагностировано 11 осложнений (8.5%);
–второй период с 2009-го по 2011 год. За этот период выполнена 351 операция, диагностировано 12 осложнений (3.4%);
–третий период с 2012-го по 2015 год. За этот период выполнено 548 операций, диагностировано 7 осложнений (1.2%).
Так, при анализе постманипуляционных осложнений в различные периоды деятельности отмечено умеренное снижение частоты таких видов осложнений, как кровотечение, острый панкреатит, холангит во втором периоде по сравнению с первым периодом и значительное снижение аналогичных показателей в третьем периоде по сравнению, как
спервым, так и со вторым периодом деятельности. В третьем периоде деятельности отсутствуют осложнения, обусловленные сопутствующей соматической патологией (инсульт, инфаркт миокарда). Единственным показателем с отрицательной динамикой является такой вид осложнения, как миграция билиарного стента в общий желчный проток. В первую очередь это связано как с малым количеством выполненных стентирований общего желчного протока в первом периоде деятельности, так и с расширением показаний к стентированию желчных путей во втором периоде деятельности, несоблюдением пациентами графика контрольных осмотров и необоснованными попытками санации инкрустированных стентов из-за отсутствия соответствующего опыта.
Для первого периода деятельности большое количество диагностированных осложнений можно объяснить ведущим фактором — отсутствием необходимого опыта оперирующего эндоскописта с позиций технической оснащенности и тактического подхода в зависимости от выявленной патологии. Возникновению большего количества осложнений способствовали следующие манипуляции:
–контрастирование протоковой системы из ампулы БДС из-за отсутствия высокоинформативных, уточняющих видов диагностических исследований;
–частое попадание струны, канюли или папиллотома в главный панкреатический проток без проведения аспирационной пробы и последующих превентивных мероприятий;
–необоснованная агрессивная гемостатическая терапия с использованием инфильтрационного гемостаза или коагуляции кровоточащих сосудов при кровотечении первой и второй степени активности;
–многократные безуспешные попытки канюляции ампулы большого дуоденального сосочка (БДС)
споследующим, «запоздавшим», проведением атипичной папиллотомии, приводящие к травме тканей большого дуоденального сосочка.
Вэтот период деятельности отсутствовала соответствующая предоперационная подготовка с целью снижения ферментативной активности поджелудочной железы и адекватной релаксации кишечника, была продолжительной, до 120 минут, операция. Отмечено стремление одномоментного разрешения клиники механической желтухи с увеличением длины папиллотомического разреза на первом сеансе лечебной эндоскопической ретроградной холангиопанкреатикографии (ЭРХПГ), которое приводило к осложнениям: кровотечению, холангиту, острой сердечной недостаточности. На этот период приходится единственный летальный исход от острой сердечно-сосудистой недостаточности.
Основным критерием разграничения периодов стали ключевые, на наш взгляд, профилактические и лечебные мероприятия, направленные на снижение транспапиллярных осложнений.
Так, во втором периоде 2009-2011 гг. весомый вклад в снижение количества постманипуляционных осложнений сыграло внедрение в клиническую практику эндосонографии, которая вместе с дуоденоскопией вошла в стандарт алгоритма предоперационной диагностики больных с патологией панкреатобилиарной области. Для данных видов исследований, перед проведением эндоскопического оперативного лечения, стояли следующие задачи:
–оценка состояния и характера изменений поджелудочной железы, внепеченочных желчных путей, двенадцатиперстной кишки;
–выявление анатомо-топографические особенностей зоны операционного доступа;
–определение дальнейшей тактики лечения. Проведение эндосонографии позволило полно-
стью упразднить контрастирование протоковых систем с диагностической целью, а также на 25% снизить число плановых эндоскопических транспапиллярных вмешательств из-за немалого (до 35%) количества ложноположительных результатов лучевых методов исследований. Однако
хирургия

32 |
|
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
‘6 (91) ноябрь 2015 г. |
|
|||
|
|
|
|
|
|
|
|
стоит отметить, что эндосонография является сложным диагностическим методом, требующим специальной подготовки для квалифицированной интерпретации находок. Так, нами наблюдались два случая постманипуляционного отечного панкреонекроза у молодых женщин, вследствие эндосонографической гипердиагностики холедохолитиаза.
Впериод 2009-2011 гг. были расширены показания для стентирования желчных путей в группе больных с доброкачественной патологией панкреатобилиарной области, особенно со сложными анатомо-топографическими изменениями, затрудняющими доступ в желчные пути (после резекции желудка по Бильрот-2, интрадивертикулярном расположении БДС). Выполнение 150 стентирований желчных путей позволили предупредить развитие клиники постманипуляционного панкреатита в 98.7% случаев.
Вэтот же период у 8 больных внедрена и успешно выполнена методика комплексного лечения тубулярных папиллостенозов третьей степени при наличии холецистолитиаза. Так, при невозможности ретроградной селективной катетеризации желчного протока, для исключения дальнейших не контролируемых манипуляций в области БДС, выполняли лапароскопическую холецистэктомию с дренированием холедоха по Пиковскому. Через 4-5 дней после лапароскопической холецистэктомии выполняли очередной этап лечебной ЭРХПГ, во время которой через дренаж, установленный в холедох через пузырный проток, вводили физиологический раствор, окрашенный метиленовый синькой. Искусственно создаваемая билиарная гипертензия позволила верифицировать устье холедоха и успешно разрешить папиллостеноз.
Изменилось отношение и к кровотечениям из папиллотомического разреза первой и второй степени активности. Выполняли внутримышечное введение дицинона 4.0 мл и орошение холодным физиологическим раствором верхних краев раны с последующей экспозицией в течение 15 минут. В 90% случаев выжидательная тактика была оправдана и позволяла продолжить операцию. При продолжающемся кровотечении и формировании гемотампонады в области БДС выполняли инфильтрацию подслизистого слоя сосудосуживающими препаратами, стентирование желчных путей с удалением кровяных сгустков. Для предотвращения кровотечений у пациентов с клиникой механической желтухи вмешательства проводили после оценки степени нарушения свертывающей системы крови и предоперационной гемостатической терапии.
Мероприятиями, предупреждающими развитие таких грозных осложнений, как острая сердечнососудистая недостаточность и инсульт, стали сокращение длительности оперативного вмешательства до 40-45 минут во втором периоде и до 30 минут в третьем периоде деятельности и обязательная предварительная консультация кардиолога у лиц старше 50 лет.
Вкачестве предоперационной подготовки стали применять октеротид для угнетения экзокринной функции поджелудочной железы, уменьшения протеолиза и внутрипротокового давления. Во избежание проявления нежелательного эффекта октреотида в виде увеличения базального давления
ичастоты сокращений сфинктера Одди на весь период лечения использовали ректальные свечи бускопана.
При наличии гнойного холангита выполняли наружное дренирование желчных путей с проведением бактериологического посева желчи. Длительная санация желчных путей в сочетании с интенсивными реанимационными мероприятиями позволил у двух пациентов разрешить клинику восходящего холангита и сепсиса. Результат методики папиллодилатации, по результатам нашего небольшого опыта, выглядит противоречиво. В трез из 10 баллонных папиллодилатациях (30%) вмешательство осложнилось развитием острого панкреатита, в результате чего мы отказались от дальнейшего проведения данного вида операций.
При развитии клиники острого постманипуляционного панкреатита, на вторые сутки, выполняли экстренное стентирование главного панкреатического протока, что позволило у 7 больных предупредить развитие панкреонекроза.
Ключевым профилактическим мероприятием третьего периода деятельности, отличающим его от первого и второго периодов деятельности, стало активно проводимое, в 20% случаев, стентирование главного панкреатического протока, позволившее снизить количество острых панкреатитов до 0.5%. В период с 2012 по 2015 г. стентирование главного панкреатического протока было выполнено во всех случаях прогнозируемого высокого риска развития осложнений:
–при попадании канюли или папиллотома в главный панкреатический проток, сопровождавшихся возникновением болевого синдрома, особенно у лиц женского пола, в сочетании с признаками папиллостеноза, интрадивертикулярного расположения БДС, ЭРХПГ-индуцированного панкреатита в анамнезе;
–при тонкой септе между устьями холедоха и панкреатичсекого протока с целью их разграничения и удобства последующей селективной канюляции общего желчного протока.
При наличии крупных конкрементов от 15 до 30 мм
вдиаметре мы прибегали к практике «искусственного» вклинения корзины с конкрементом в желчном протоке и дробления конкрементов с использованием аварийного устройства под рентгенологическим контролем. За период 2007-2015 гг. данным способом успешно, без осложнений и конверсии на лапаротомию, выполнено 54 литотрипсии.
Ни в одном случае наблюдения других постманипуляционных осложнений не потребовалось открытой операции. Так, в одном случае ретроградной перфорации, сформировавшийся абсцесс забрюшинного пространства, был успешно устранен двукратной пункцией полости под ультразвуковым контролем. В другом случае перфорация осложнилась тотальной эмфиземой подкожной клетчатки, излеченная интенсивной консервативной терапией с выпиской пациентки на 8-е сутки после операции. При перфорации холедоха, после бужирования короткой рубцовой стриктуры, был установлен билиарный стент с хорошим эффектом. Возникшее интенсивное желудочно-кишечное кровотечение в области кардиоэзофагеального перехода остановлено с проведением эндоскопического гемостаза. Наблюдавшиеся в клинике случаи миграции стентов (5 из 150 стентирований — 3.3 %) были также успешно разрешены эндоскопическим путем.
Таким образом, разработанный комплекс профилактических и лечебных мероприятий позволил снизить количество осложнений с 8.5% в период
2007-2008 гг. до 1.2% в период 2014-2015 годов.
хирургия

‘6 (91) ноябрь 2015 г. |
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
|
33 |
|
|||
|
|
|
|
|
|
|
|
ЛИТЕРАТУРА
1.Дерябина Е.А., Братникова Г.И., Васильев А.В. Повышение безопасности лечебных эндоскопических ретроградных холангиопанкреатографий у больных с доброкачественными обструктивными заболеваниями желчевыводящих путей // Медицинская визуализация. — 2010. — №2. — С. 73-80.
2.Котовский А.Е., Глебов К.Г., Уружумцева Г.А. и др. Эндоскопические технологии в лечении заболеваний органов гепатопанкреатодуоденальной зоны // Анналы хирургической гепатологии.
—2010. — №1. — С. 9-18.
3.Jeurnink S.M., Siersema P.D., Steyerberg E.W. Predictors of complications after endoscopic retrograde cholangiopancreatography: a prognostic model for early discharge // Surg. Endosc. — 2011. — Vol. 25, №9. — P. 2892-2900.
4.Costamagna G., Tringali A., Shah S.K. et al. Long-term follow-up of patients after endoscopic sphincterotomy for choledocholithiasis, and risk factors for recurrence // Endoscopy. — 2002. — Vol. 34, №4. — P. 273-279.
9.Kahaleh М., Freeman М. Prevention and management of postendoscopic retrograde cholangiopancreatography complications // Clin. Endosc. — 2012. — Vol. 45. — P. 305-312.
10.Ревякин В.И., Василенко К.В. Методы устранения вклинения корзины Дормиа в желчных протоках // Эндоскопическая хирургия. — 2010. — №4. — С. 30-33.
11.Бурдюков М.С. Диагностическая и лечебная эндоскопия при опухолях органов билиопанкреатодуоденальной зоны: автореф. дис… канд. мед. наук. — М., 2010. — 30 с.
12.Anderson M.A., Fisher L., Jain R. et al. Complications of ERCP. ASGE Standards of Practice Committee // Gastrointest. Endosc. — 2012. — Vol. 75, №3. — P. 467-473.
13.Dumonceau J. M., Andriulli A., Deviere J. et al. European Society of Gastrointestinal Endoscopy (ESGE) Guideline: prophylaxis of post-ERCP pancreatitis // Endoscopy. — 2010. — Vol. 42, №6. — P. 503-515.
14.Tsuchiya T., Itoi T., Sofuni A. et al. Тemporary pancreatic stent
5.Манцеров М.П., Мороз Е.В. Реактивный панкреатит после энto prevent post endoscopic retrograde cholangiopancreatography
доскопических манипуляций на большом дуоденальном сосочке // РЖГГК. — 3. — 2007. — С. 14-23.
6. Freeman M.L., DiSario J.A., Nelson D.B. et al. Risk factors for post-ERCP pancreatitis: a prospective, multicenter study // Gastrointest. Endosc. — 2001. — Vol. 54. — P. 425-434.
7. Masci E., Mariani A., Curioni S., Testoni P.A. Risk factors for pancreatitis following endoscopic retrograde cholangiopancreatography: a meta-analysis // Endoscopy. — 2003. — Vol. 35, №10. — P. 830-834.
8. Гальперин Э.И. Руководство по хирургии желчных путей. — М.: Видар, 2009. — 568 с.
pancreatitis: a preliminary, single-center, randomized controlled trial //
J.Hepatobiliary Pancreat. Surg. — 2007. — Vol. 14. — P. 302-307.
15.Kawaguchi Y., Ogawa M., Omata F. et al. Randomized controlled trial of pancreatic stenting to prevent pancreatitis after endoscopic retrograde cholangiopancreatography// World J. Gastroenterol. — 2012. — Vol. 18, №14. — P. 1635-1641.
16.Elmunzer B.J., Scheiman J.M., Lehman G.A. et al. A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis // N. Engl. J. Med. — 2012. — Vol. 366. — P. 1414-1422.
17.Lazaraki G. Prevention of post ERCP pancreatitis: an overview // Ann. Gastroenterol. — 2008. — Vol. 21, №1. — P. 27-38.
новое в медицине. ИНТЕРЕСНЫЕ ФАКТЫ
Новый источник аутологичных стволовых клеток для заживления ран
Обширные травматические повреждения, например, захватывающие большую площадь ожоги, ограничивают возможности получения аутологичных стволовых клеток для заживления ран.
Американские ученые и военные медики из United States Army Institute of Surgical Research в своем исследовании показали, что резидентные стволовые клетки подкожной жировой ткани выживают даже после тяжелых ожогов и остаются пригодными для терапевтического использования. Из оставшихся после очищения раны остатков кожи, содержащих подкожную клетчатку, удается выделить приблизительно 1.5×105 — 2.5×105 клеток на 1 грамм ткани. Таким образом, удаляемые при очищении ран и ожогов ткани, которые обычно выбрасывают, могут быть ценным источником стволовых клеток.
Иммуногистохимические исследования показали, что фенотипом и свойствами стволовых клеток обладают
экспрессирующие PDGFRβ(+) клетки, сосредоточенные в периваскулярных нишах. Анализ генной экспрессии на специфические транскрипты стволовых клеток (СК) выявил, что полученные СК при культивировании продолжают экспрессировать эти маркеры (т.е. сохраняют «стволовость») даже после нескольких пассажей. Кроме того, эти клетки оказались способны к дифференцировке в клетки жировой и костной ткани, а также сосудистого эндотелия.
Таким образом, установлен новый источник стволовых клеток, пригодных для использования в лечении ран и ожогов, а также в других областях регенеративной терапии. По мнению доктора П.И. Катуняна, главного врача московского Центра медико-биологических технологий, предложенный американскими исследователями метод получения аутологичных стволовых клеток может иметь особенно большие преимущества при лечении крупных повреждений.
Источник: www.stemcells.ru
хирургия

34 |
|
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
‘6 (91) ноябрь 2015 г. |
|
|||
|
|
|
|
|
|
|
|
удк 616.379-008.64-06:617.586
К.А. КОРЕЙБА1,2, А.Р. МИНАБУТДИНОВ2
1Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49 2Центр «Диабетическая стопа», 420127, г. Казань, ул. Максимова, д. 34/24
Предложения по применению классификаций
при диагностике синдрома диабетической стопы
в практике хирурга
Корейба Константин Александрович — кандидат медицинских наук, доцент кафедры общей хирургии КГМУ, руководитель центра «Диабетическая стопа», тел. +7-917-259-47-47, e-mail: korejba_k@mail.ru
Минабутдинов Айдар Рамилевич — врач центра «Диабетическая стопа», тел. +7-965-589-88-91, e-mail: diabetstopa5gb@mail.ru
Синдром диабетической стопы является одним из грозных осложнений сахарного диабета, обусловливающих одну из основных причин инвалидизации и смертности. Постановка точного клинического диагноза при синдроме диабетической стопы является важнейшим и приоритетным этапом в работе врача, становясь отправной точкой для своевременной квалифицированной медицинской помощи. В настоящее время имеется немало классификаций синдрома диабетической стопы, однако они малоприменимы в обыденной клинической практике врача ввиду сложности и громоздкости. В центре «Диабетическая стопа» г. Казани предложено использование нескольких классификаций, дополняющих характеристику заболевания и позволяющих поставить клинический диагноз, понятный клиническому врачу.
Ключевые слова: синдром диабетической стопы, классификация, центр «Диабетическая стопа» г. Казани.
K.A. KOREYBA1,2, A.R. MINABUTDINOV2
1Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012 2«Diabetic Foot» Center, 34/24 Maksimov St., Kazan, Russian Federation, 420127
Proposals on using classifications when diagnosing the diabetic foot syndrome in surgery practice
Koreyba K.A. — Cand. Med. Sc., Associate Professor of the Department of General Surgery of KSMU, Head of «Diabetic Foot» Center, tel. +7-927-412-87-03, e-mail: korejba_k@mail.ru
Minabutdinov A.R. — surgeon of «Diabetic Foot» Center, tel. +7-965-589-88-91, e-mail: diabetstopa5gb@mail.ru
Diabetic foot syndrome is one of the serious complications of diabetes mellitus, one of the major causes of morbidity and mortality. An accurate clinical diagnosis of diabetic foot syndrome is an important step and a priority in the work of the doctor, as a starting point for a qualified timely medical assistance. Currently, there are many classifications of diabetic foot syndrome, but they are not very applicable in everyday clinical practice due to the complexity and bulkiness. The «Diabetic Foot» Center (Kazan) proposed a simple and reasonable classification, allowing fast and clear clinical diagnosis understandable for the clinician.
Key words: diabetic foot syndrome, classification, «Diabetic Foot» Center.
В 2014 г. число взрослых больных сахарным диа- |
нальных изменений стопы у больного сахарным диа- |
бетом I и II типа в мире достигло рекордных 387 |
бетом, связанных с диабетической нейропатией, |
миллионов человек [1]. По данным Государствен- |
ангиопатией, остеоартропатией, на фоне которых |
ного регистра РФ, на 01.01.2013 г. официально |
развиваются гнойно-некротические процессы [3]. |
зарегистрировано 3 млн 782 тыс. (около 2,6% от |
Подходы к лечению больных с СДС должны быть |
общей численности населения РФ). Данная катего- |
комплексными и мультидисциплинарными. Важ- |
рия пациентов имеет высокий риск развития син- |
ную роль в разработке адекватной лечебной так- |
дрома диабетической стопы (СДС), встречающегося |
тики любой патологии играют точное определение |
у 20-80% больных [2]. |
локализации очага альтерации, характер и объем |
Синдром диабетической стопы (СДС), согласно |
последнего в соответствии с принятой классифика- |
Международному соглашению по диабетической |
цией, а также воспалительные изменения в тканях, |
стопе (2000 г.) — это комплекс анатомо-функцио- |
граничащих с очагом инфекции. |
хирургия

‘6 (91) ноябрь 2015 г. |
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
|
35 |
|
|||
|
|
|
|
|
|
|
|
Однако классификация поражения тканей при СДС до сих пор не имеет окончательной редакции, что во многом объясняет количество ошибок, встречающихся в ходе лечения таких больных, которые чреваты тяжелыми необратимыми последствиями для больного. Первостепенное значение для диагностики и определения «дорожной карты» пациента имеет классификация заболевания.
Классическая патогенетическая триада СДС включает ишемию, нейропатию и инфекцию. Все эти факторы могут вызывать развитие СДС как самостоятельно, так и в комплексе с другими причинами. Исходя из преобладания того или иного фактора, различают 3 формы СДС: ишемическую (10%), нейропатическую (55%) и смешанную (34%) [3]. Однако работы профессора И.В. Гурьевой наглядно доказывают, что выделение ишемической формы нецелесообразно. Она предлагает выделять три формы: 1) нейропатическую; 2) нейроостеоартропатическую и 3) нейроишемическую [4, 5]. Выделение этих форм удобно, но с точки зрения язвенных и гнойно-некротических осложнений СДС и тактических подходов к оперативному лечению неприемлемо, так как не отражает особенностей и различий осложнений, поэтому не может служить основой для выработки стандартов хирургического лечения [6].
Существует также классификация диабетической стопы техасского университета, которая оценивает риск возникновения язвы и риск ампутации, и отдельная классификация диабетических язв, которая учитывает степень и стадию язвенного дефекта. Данные классификации достаточно полно и точно описывают патологический процесс при синдроме диабетической стопы, однако их применение в клинической практике рядовым хирургом затруднительно ввиду «объемности и тяжести» этих классификаций.
В построении базовой классификации местных поражений тканей при синдроме диабетической стопы необходимо исходить из определения данного процесса. В настоящее время одной из наиболее распространенных является классификация СДС, предложенная Wagner в 1981 г. [7]:
Нулевая ст. — интактная кожа, возможны гиперемия, предъязвенные изменения кожи, костные деформации;
1-я ст. — поверхностный язвенный дефект; 2-я ст. — глубокая язва (в дне язвы подкожно-
жировая клетчатка, сухожилия, капсула сустава); 3-я ст. — глубокая язва, проникающая до костных структур, полости суставов, с признаками ин-
фицирования; 4-я ст. — ограниченная гангрена (пальцы, пятка
или гангрена до трансметатарзального уровня); 5-я ст. — распространенная гангрена.
Данная классификация в силу своей простоты используется наиболее широко, она прошла про-
верку временем и удобна для практикующего врача. Однако и эта классификация имеет свои недостатки: в пунктах 2 и 3 мягкие ткани стопы рассматриваются как единое целое, этакий конгломерат. Известно, что это далеко не так. Назрела необходимость в создании такой же простой, но более детализированной по мягкотканым образованиям стопы классификации. Поэтому для удобства определения глубины поражения, уточнения локализации процесса и, учитывая послойность строения мягких тканей стопы, предлагаем дополнить классификацию F.W. Wagner (1981), именно в п. 2 и 3, классификацией D.H. Ahrenholz (1991) [8]. В этом случае она выглядит следующим образом:
0.Язвенный дефект отсутствует, но есть сухость кожных покровов, деформация пальцев, выступание головок метатарзальных костей.
1.Поверхностная язва
а — поражение собственно кожи; б — поражение подкожной клетчатки.
2.Глубокая язва, без вовлечения в процесс костной ткани
а — поражение поверхностной фасции; б — поражение мышц и глубоких фасциальных
структур.
3.Глубокая язва с абсцедированием и вовлечением в процесс костных структур.
4.Ограниченная гангрена (пальцы или часть стопы).
5.Гангрена всей стопы.
Для оценки тяжести ишемии применяем классификацию хронической артериальной недостаточности Фонтейн — Лериша — Покровского:
I стадия — бессимптомное атеросклеротическое поражение артерий, выявляемое только при инструментальном исследовании.
II стадия — артериальная недостаточность, возникающая при функциональной нагрузке (перемежающаяся хромота):
—боли при ходьбе на расстояние более 50 м;
—боли при ходьбе на расстояние менее 50 м. III стадия — артериальная недостаточность в
покое (ишемия покоя).
IV стадия — трофические нарушения, некроз тканей и/или гангрены.
Однако использование классификации Фонтейна — Лериша — Покровского при нейроишемической форме СДС встретило затруднения. Согласно ее условиям, ишемия 1-й, 2-й и 3-й степени диагностируется по ощущению боли, которой при нейроишемии может не быть [9]. Поражение нервной системы проводим согласно шкале нейропатического дисфункционального счета (НДС):
Оценка: 0-4 балла — отсутствие или начальные признаки ДПН; 5-13 баллов — умеренно выраженная ДПН; 14 и более баллов — выраженная ДПН [3].
Локализация |
|
Чувствительность¹ |
Рефлексы² |
||
|
|
|
|
|
|
|
Тактильная |
|
Болевая |
Температурная |
коленный/ |
|
|
|
|
|
ахиллов |
|
|
|
|
|
|
Итог: сумма НДС = (сумма рефлексов+сумма всех видов чувствительности)
Примечание:10 — норма; 1 — отсутствие в пальцах стоп; 2 — отсутствие до уровня середины стопы; 3 — отсутствие до уровня лодыжек; 4 — отсутствие до середины голеней; 5 — отсутствие до уровня колен); ²(0 — норма; 1 — ослабление; 2 — отсутствие)
хирургия
36 |
|
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
‘6 (91) ноябрь 2015 г. |
|
|||
|
|
|
|
|
|
|
|
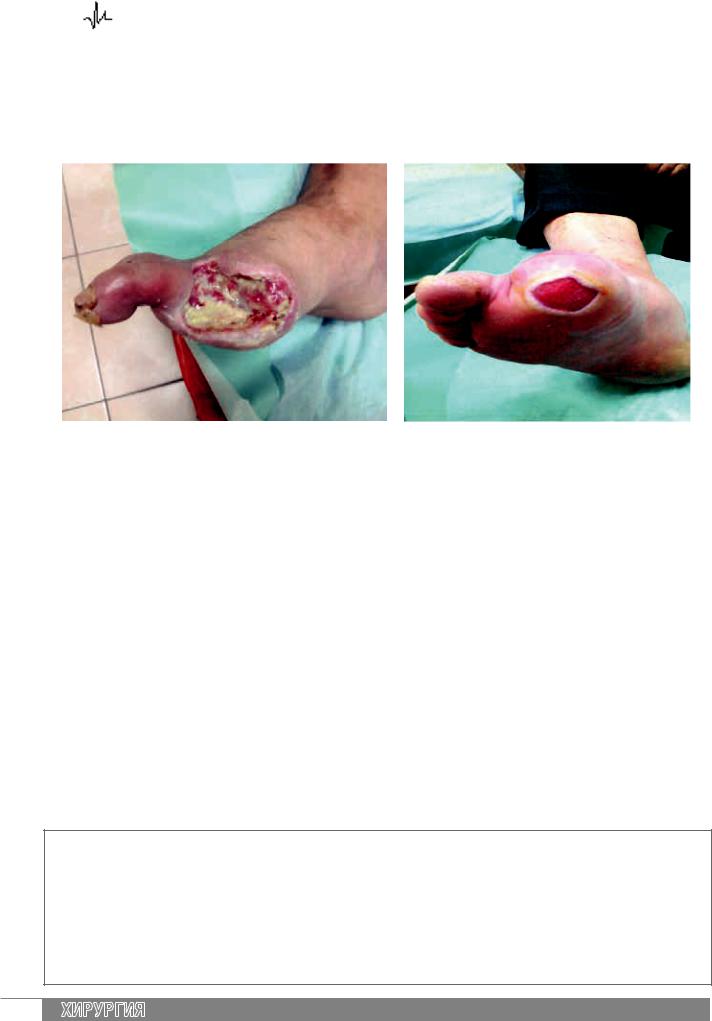
Приводим примеры диагнозов, которые понятны |
|
||
всем специалистам, курирующим больного с син- |
|
||
дромом диабетической стопы. |
|
||
Больной В., 64 года. Диагноз: СДС 2а, нейроише- |
Больной Ш., 59 лет. Диагноз: СДС 1а, нейроише- |
||
мическая форма. ХАН 2б. Диабетическая полиней- |
мическая форма. ХАН 2б. Диабетическая полиней- |
||
ропатия дистальная, сенсомоторная форма. Диабе- |
ропатия дистальная, сенсомоторная форма. Диабе- |
||
тическая остеоартропатия. |
тическая остеоартропатия. |
||
ЛИТЕРАТУРА |
5. Грекова Н.М. Хирургия диабетической стопы / Н.М. Грекова, |
1.Электронныйресурс.URL:http://www.idf.org/worlddiabetesday/ |
В.Н. Бордуновский. — М.: Медпрактика-М, 2009. — 188 с. |
toolkit/gp/facts-figures |
6. Кисляков В.А. Хирургическая классификация язвенных, гной- |
2. Hiner G. NICE Guidelines & Inpatient Care of Patients with |
но-некротических осложнений синдрома диабетической стопы / |
Diabetic Foot Ulcers / G Hiner, A Bhatty, SM Rajbhandari // XII Meeting |
В.А. Кисляков // Международный эндокринологический журнал. |
of the Diabetic Foot Study Group of the EASD. — Bratislava, Slovakia, |
— 2009. —№6(24). |
2014. — P. 62. |
7. Wagner F.W. The dysvascular foot: A system for diagnosis and |
3. Комелягина Е.Ю. Русскоязычная версия опросника для оценки |
treatment / F.W. Wagner // Foot Ankle. — 1981. — Vol. 2, №2. — |
качества жизни у больных с периферической полинейропатией: ва- |
P. 64-122. |
лидация и перспективы применения / Е.Ю. Комелягина, О.М. Уваро- |
8. Ahrenholz D.H. Neorotizirig fastitis and other infections // |
ва, М.Б. Анциферов // Сахарный диабет. — 2014. — №2. — С. 56-65. |
Intensive Care Medicine / J.M. Rippe, R.S. Irwin, J.C. Al-per, M.Q. Fink |
4. Гурьева И.В. Профилактика, лечение, медико-социальная ре- |
(eds). — 2nd ed Boston: Little, Brown, 1991. — P. 1334. |
абилитация и организация междисциплинарной помощи больным |
9. Бенсман В.М. Дискуссионные вопросы классификации син- |
с синдромом диабетической стопы: aвтореф. дис. … д-ра мед. наук / |
дрома диабетической стопы / В.М. Бенсман, К.Г. Триандафилов // |
И.В. Гурьева. — М., 2002. — 32 с. |
Хирургия. — 2009. — №4. — С. 39. |
|
|
|
|
ПОДПИСНОЙ ИНДЕКС ЖУРНАЛА «Практическая медицина»
Вкаталоге «Роспечать» 37140
Вреспубликанском каталоге ФПС «Татарстан Почтасы» 16848
хирургия

‘6 (91) ноябрь 2015 г. |
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
|
37 |
|
|||
|
|
|
|
|
|
|
|
удк 617.55-007.43-06:612.014.462.5
Т.Н. АББАСЗАДЕ1, А.М. ХРОМОВА2, А.Ю. АНИСИМОВ3
1НИИ экспериментальной и клинической хирургии им. акад. М.А. Топчибашева, 1122, г. Баку, ул. Шарифзаде, д. 196
2Республиканское бюро судебно-медицинской экспертизы, 420029, г. Казань, Сибирский тракт, д. 31а 3Казанская государственная медицинская академия, 420012, г. Казань, ул. Бутлерова, д. 36
Возможности аргон-плазменной коагуляции в профилактике ранних послеоперационных
раневых осложнений при герниопластике больших вентральных грыж
Аббасзаде Турал Надир Оглы — кандидат медицинских наук, старший научный сотрудник, тел. +9-945-029-900-84, e-mail: turalabbaszade@yandex.ru
Хромова Алла Михайловна — кандидат медицинских наук, заведующая судебно-гистологическим отделением, тел. (843) 273-91-55, e-mail: Alla.Hromova@tatar.ru
Анисимов Андрей Юрьевич — доктор медицинских наук, профессор, заведующий кафедрой скорой медицинской помощи, тел. (843) 221-36-70, е-mail: aanisimovbsmp@yandex.ru
Для профилактики ранних послеоперационных раневых осложнений у 14 из 52 больных большими вентральными грыжами использовали аргон-плазменную коагуляцию мягких тканей операционной раны с помощью электрохирургического генератора FORCE FX с блоком подачи газа аргон. При этом методом алгоритмизированного топографического изъятия и исследования участков тканей с использованием унифицированного протокола гистологического исследования и диагностической иммуногистохимической панели изучили морфологические изменения в мягких тканях операционной раны в результате воздействия аргон-плазменной коагуляции и без нее. Полученные клинические и морфологические данные позволили сделать вывод о том, что наиболее предпочтительным методом профилактики ранних послеоперационных раневых осложнений после герниопластики по поводу больших вентральных грыж является обработка аргон-плазменной коагуляцией мягких тканей операционной раны.
Ключевые слова: большая вентральная грыжа, аргон-плазменная коагуляция, диагностика, гистологическое исследование, иммуногистохимическая панель, ранние послеоперационные раневые осложнения.
T.N. ABBASZADE1, A.M. KHROMOVA2, A.Yu. ANISIMOV2
1Scienntific-Research Institute of Experimental and Clinical Surgery named after Academician M.A. Topchibashev, 196 Sharifzade St., Baku, Azerbaijan Republic, 1122
2Republican Bureau of Forensic Medical Expertise, 31a Sibirskiy Trakt, Kazan, Russian Federation, 420029 3Kazan State Medical Academy, 36 Butlerov St., Kazan, Russian Federation, 420012
Argon plasma coagulation facilities in prevention of early postoperative wound complications during repair of large ventral hernias
Abbaszade T.N. — Cand. Med. Sc., Senior Researcher, tel. +9-945-029-900-84, e-mail: turalabbaszade@yandex.ru
Khromova A.M. — Cand. Med. Sc., Head of Forensic-Histological Department, tel. (843) 273-91-55, e-mail: Alla.Hromova@tatar.ru
Anisimov A.Yu. — D. Med. Sc., Professor, Head of Emergency Medical Care Department, tel. (843) 221-36-70, е-mail: aanisimovbsmp@yandex.ru
хирургия

38 |
|
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
‘6 (91) ноябрь 2015 г. |
|
|||
|
|
|
|
|
|
|
|
For the prevention of early postoperative wound complications in 14 of 52 patients with large ventral hernias, we used argon plasma coagulation of surgical wound soft tissues with the use of electrosurgical generator FORCE FX unit with argon gas supply. The algorithmic topographic method of withdrawal and study of the tissue sites using a unified protocol of histological examination and diagnostic immunohistological panel allowed to study the morphological changes in the surgical wound soft tissues as a result of argon plasma coagulation exposure and without it.
These clinical and morphological data led to the conclusion that the most preferred method for the prevention of early postoperative wound complications after large ventral hernia repair is the treatment of surgical wound soft tissues with argon plasma coagulation.
Key words: large ventral hernia, argon plasma coagulation, diagnosis, histological examination, immonohistological panel, early postoperative wound complications.
Многолетняя практика герниологии убедительно свидетельствует о том, что «…хирургическое лечение крупных дефектов брюшной стенки является испытанием для каждого хирурга» [1, 2]. Одним из факторов, способствующих возникновению большой вентральной грыжи, является использование методики «открытого живота» — лапаростомии [3, 4]. С одной стороны, этот метод хирургического воздействия на эндотоксикоз улучшает ближайшие результаты лечения наиболее тяжелой группы больных распространенным перитонитом и инфицированным панкреонекрозом [5, 6]. С другой, его применение не только решило, но и поставило перед клиницистами ряд задач. В частности задачу хирургической коррекции больших послеоперационных вентральных грыж после купирования
воспалительного процесса в брюшной полости
[7, 8].
Частота местных послеоперационных раневых осложнений при герниопластике вентральных грыж больших размеров достигает 4,6-11,8%, в том числе сером — 11,8%: инфильтратов — 17,5%: гематом — 8,6% [9-11]. В отдельности или в комбинации вышеперечисленные осложнения приводят к развитию рецидива заболевания у 5-69% больных
[12, 13].
Сегодня проблема выбора режимов профилактики ранних послеоперационных раневых осложнений после герниопластики по поводу больших вентральных грыж отнесена к вопросам, требующим дальнейшего изучения в доказательных многоцентровых исследованиях.
Таблица 1.
Характеристика полнокровия мягких тканей операционной раны
Характеристика признака |
Степень выраженности признака |
||
|
|
||
Основная группа |
Группа сравнения |
||
|
|||
|
|
|
|
Уровень сосудистой организации |
|
|
|
Артерии мелкие |
+ |
- |
|
Артерии средние |
+ |
- |
|
Артерии крупные |
+++ |
++ |
|
Вены мелкие |
+ |
- |
|
Вены средние |
++ |
+ |
|
Вены крупные |
++ |
++ |
|
Микроциркуляторное русло |
++ |
+ |
|
Степень выраженности |
|
|
|
Артерии мелкие |
+ |
--- |
|
Артерии средние |
+ |
- |
|
Артерии крупные |
+++ |
+ |
|
Вены мелкие |
++ |
-- |
|
Вены средние |
+ |
+ |
|
Вены крупные |
+++ |
++ |
|
Микроциркуляторное русло |
+ |
+++ |
|
умеренное |
|
|
|
Микроциркуляторное русло |
+++ |
+ |
|
значительное |
|
|
|
Микроциркуляторное русло |
++ |
+ |
|
паретическое |
|
|
|
Распространенность по топографии |
|
|
|
Артерии очаговое |
- |
+++ |
|
Артерии диффузное |
+++ |
+ |
|
Вены очаговое |
- |
+++ |
|
Вены диффузное |
+++ |
+ |
|
Микроциркуляторное русло |
+ |
- |
|
Микроциркуляторное русло очаговое |
+ |
- |
|
Микроциркуляторное русло диффузное |
+++ |
+ |
|
хирургия

‘6 (91) ноябрь 2015 г. |
|
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
|
39 |
|||
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
На современном этапе развития клинической гер- |
Для профилактики |
ранних послеоперационных |
|||||
ниологии большие надежды в аспекте профилак- |
раневых осложнений у 14 (26,9%) больных после |
||||||
тики ранних послеоперационных раневых ослож- |
герниопластики грыжевых ворот мы использовали |
||||||
нений связывают с аргон-плазменной коагуляцией |
аргон-плазменную коагуляцию подкожной клетчат- |
||||||
мягких тканей операционной раны [14-16]. Исходя |
ки и мягких тканей с помощью электрохирургиче- |
||||||
из вышесказанного, были определены цель и ос- |
ского генератора FORCE FX с блоком подачи газа |
||||||
новные задачи исследования. |
|
аргон (Valleylab, США). |
|
||||
Цель исследования — изучить возможности |
В морфологическом разделе исследования изуче- |
||||||
использования аргон-плазменной коагуляции мяг- |
ны изменения в мягких тканях операционной раны |
||||||
ких тканей операционной раны для профилактики |
в результате воздействия аргон-плазменной коагу- |
||||||
ранних послеоперационных раневых осложнений |
ляции и без нее. |
|
|
|
|||
у больных большими вентральными грыжами. |
Предварительно нами предложен метод алгорит- |
||||||
|
|
|
мизированного топографического изъятия и иссле- |
||||
Материал и методы |
|
дования участков тканей операционной раны. На |
|||||
Проведен анализ результатов хирургического ле- |
завершающем этапе операции участки подкожной |
||||||
чения 52 больных с большими вентральными гры- |
жировой клетчатки в области операционной раны |
||||||
жами (БВГ) за период с 2008 по 2014 год. Мужчин |
для гистологического исследования вырезали попе- |
||||||
было 11 (21,2%), женщин — 41 (78,8%). Возраст |
речно по отношению к средней линии раны с таким |
||||||
пациентов варьировал от 32 до 76 лет. Средний |
расчетом, чтобы в дальнейшем при изготовлении ги- |
||||||
возраст составил 55,7±1,8 года. |
|
стологических срезов и интерпретации результатов |
|||||
Для оценки размеров грыжевых выпячиваний |
можно было судить о локализации и распространен- |
||||||
использовали классификацию вентральных грыж |
ности. Толщина изъятых кусочков тканей составляла |
||||||
J.P. Chevrel and A.M. Rath (SWR-classification). Боль- |
не менее 0,5-0,8 см, длина — 1-2 см. Фиксировали |
||||||
шие грыжи (w3) наблюдали — у 44 (84,6%), гигант- |
этот биологический материал в 10%-ном нейтраль- |
||||||
ские (w4) — у 8 (15,4%) пациентов. Рецидивные |
ном растворе формалина. Готовили парафиновые |
||||||
грыжи в основной группе были у 31 (59,6%) боль- |
срезы на санном и ротационном микротомах и за- |
||||||
ного, а первичные грыжи — у 21 (40,4%). |
|
ключали в полистирол под покровное стекло. |
|
||||
Таблица 2. |
|
|
|
|
|
|
|
Характеристика малокровия мягких тканей операционной раны |
|
|
|
||||
|
|
|
|
|
|
||
Характеристика признака |
|
|
Степень выраженности признака |
|
|||
|
|
|
|
|
|
|
|
|
Основная группа |
|
Группа сравнения |
|
|||
|
|
|
|
||||
|
|
|
|
|
|
|
|
Уровень сосудистой организации |
|
|
|
|
|
|
|
Артерии мелкие |
|
|
- |
|
++ |
|
|
Артерии средние |
|
|
+ |
|
+ |
|
|
Артерии крупные |
|
|
+ |
|
+ |
|
|
Вены мелкие |
|
|
- |
|
- |
|
|
Вены средние |
|
|
- |
|
++ |
|
|
Вены крупные |
|
|
+ |
|
++ |
|
|
Микроциркуляторное русло |
|
|
+ |
|
+ |
|
|
Степень выраженности |
|
|
|
|
|
|
|
Артерии мелкие |
|
|
- |
|
+++ |
|
|
Артерии средние |
|
|
+ |
|
++ |
|
|
Артерии крупные |
|
|
+ |
|
+++ |
|
|
Вены мелкие |
|
|
+ |
|
+++ |
|
|
Вены средние |
|
|
+ |
|
+ |
|
|
Вены крупные |
|
|
+ |
|
+ |
|
|
Микроциркуляторное русло |
|
|
+ |
|
+ |
|
|
умеренное |
|
|
|
|
|
|
|
Микроциркуляторное русло |
|
|
- |
|
+++ |
|
|
значительное |
|
|
|
|
|
|
|
Микроциркуляторное русло |
|
|
- |
|
+ |
|
|
паретическое |
|
|
|
|
|
|
|
Распространенность по топографии |
|
|
|
|
|
|
|
Артерии очаговое |
|
|
- |
|
+++ |
|
|
Артерии диффузное |
|
|
+ |
|
+ |
|
|
Вены очаговое |
|
|
+ |
|
++ |
|
|
Вены диффузное |
|
|
+ |
|
+ |
|
|
Микроциркуляторное русло |
|
|
- |
|
++ |
|
|
очаговое |
|
|
|
|
|
|
|
Микроциркуляторное русло |
|
|
- |
|
+++ |
|
|
диффузное |
|
|
|
|
|
|
|
хирургия

40 |
|
|
ПРАКТИЧЕСКАЯ МЕДИЦИНА |
‘6 (91) ноябрь 2015 г. |
||
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3. |
|
|
|
|
||
Характеристика кровоизлияния мягких тканей операционной раны |
|
|||||
|
|
|
|
|
|
|
Характеристика признака |
Степень выраженности характеристики признака |
|||||
|
|
|
||||
|
|
|
|
Основная группа |
|
Группа сравнения |
Источник |
|
|
|
|
||
Артерия |
|
+ |
|
+++ |
||
Вена |
|
+ |
|
++ |
||
Микроциркуляторное русло |
+ |
|
++ |
|||
Характер |
|
|
|
|
||
Артерии ректическое |
- |
|
+++ |
|||
Артерии диапедезное |
+++ |
|
- |
|||
Вены крупные |
- |
|
+++ |
|||
Вены диапедезное |
++ |
|
- |
|||
Микроциркуляторное русло |
- |
|
+++ |
|||
Форма ректических кровоизлияний в мягких тканях |
|
|||||
Очаговые |
|
+ |
|
- |
||
Полосчатые (штриховые) |
- |
|
+++ |
|||
|
|
|
|
|||
Петехиальные (точечные, |
- |
|
+++ |
|||
пылевидные) |
|
|
|
|||
Распространенность |
|
|
|
|||
Артерии периваскулярное |
- |
|
+++ |
|||
Артерии мелкоочаговые |
+++ |
|
|
|||
Артерии крупноочаговые |
- |
|
+++ |
|||
В. периваскулярное |
- |
|
+++ |
|||
Вены мелкоочаговые |
+++ |
|
+ |
|||
Вены крупноочаговые |
- |
|
+++ |
|||
Микроциркуляторное русло перива- |
+ |
|
+++ |
|||
скулярное |
|
|
|
|
||
Микроциркуляторное |
+++ |
|
+ |
|||
русло мелкоочаговое |
|
|
|
|||
Микроциркуляторное |
--- |
|
+++ |
|||
русло крупноочаговое |
|
|
|
|||
Отек в близи очага кровоизлияния |
|
|
|
|||
Отсутствует |
|
+ |
|
- |
||
Слабый |
|
+ |
|
- |
||
Сильный |
|
- |
|
+ |
||
Распространенный |
- |
|
+++ |
|||
Лейкоцитарная реакция |
|
|
|
|||
В сосуде (А; В; МцР) |
+++ |
|
+ |
|||
Периваскулярная (А; В; МцР) |
- |
|
+++ |
|||
По краям кровоизлияния |
+++ |
|
- |
|||
Для описания и количественного микроскопического исследования препаратов использовали систему анализа изображений. Она включала в микроскоп Nicon Eclipse E200 и цифровой фотоаппарат Olimpus SP 350. Увеличения объективов: х4;
х10; х40; х100.
Исходя из того, что характеристика повреждения, наличие и степень выраженности реактивных изменений носят описательный характер, мы посчитали целесообразным применить унифицированный протокол гистологического исследования [17]. Он включал стандартное исследование при окраске гематоксилин — эозином, гистохимические исследования при окраске по Ван-Гизону и по Маллори, световую фазовоконтрастную и поляризационную микроскопию.
Особое внимание обращали на регистрацию морфофункциональных признаков острого нарушения
кровообращения в артериях, венах и микроциркуляторном русле. С этой целью применили исследовательскую схему регистрации морфофункциональных признаков острого нарушения кровообращения из 32 признаков. Она включала определение полнокровия, малокровия, кровоизлияний, нарушений реологических свойств крови и тонуса сосудистой стенки. Кроме того, была разработана и использована диагностическая иммуногистохимическая панель, состоящая из трех моноклональных антител: маркера моноцитов, ранних миелоидных клеток и эндотелия — CD 34, маркера моноцитовмакрофагов и миелоидных клеток — CD 68 и маркера ранней прижизненной реакции в поврежденных мягких тканях — CD 62P.
Статистическая обработка результатов исследования выполнена с помощью пакета программ
хирургия
