
Лабораторная работа № 5 Свойства углеводов
Опыт 1. Реакция серебряного зеркала – это реакция восстановления серебра из аммиачного раствора оксида серебра (реактив Толленса).
В водном растворе аммиака оксид серебра растворяется с образованием комплексного соединения — гидроксид диамминсеребра(I) [Ag(NH3)2]OH
![]()
при добавлении к которому альдегида происходит окислительно-восстановительная реакция с образованием металлического серебра:
![]()
Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро выпадает в виде тонкой плёнки, образуя зеркальную поверхность.
При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка.
Реакция «серебряного зеркала» может использоваться как качественная реакция на альдегиды. Так, реакцию «серебряного зеркала» можно использовать как отличительную между глюкозой и фруктозой. Глюкоза относится к альдозам (содержит альдегидную группу в открытой форме), а фруктоза — к кетозам (содержащие кетогруппу в открытой форме). Поэтому глюкоза дает реакцию «серебряного зеркала», а фруктоза – нет. Но если в растворе присутствует щелочная среда, то кетозы изомеризуются в альдозы и также дают положительные реакции с аммиачным раствором оксида серебра (реактив Толленса).
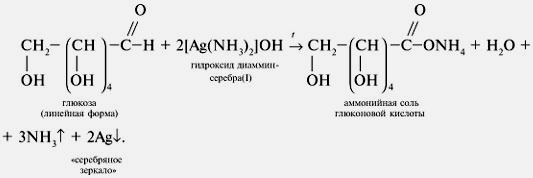
Качественная реакция глюкозы с аммиачным раствором оксида серебра. Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН)4 – СООН + 2Ag↓
Порядок выполнения работы.
В две пробирки наливают по 2 мл. аммиачного раствора оксида серебра. В одну из них добавляют 2 мл. 1%-ного раствора глюкозы, в другую – фруктозы. Обе пробирки кипятят.
Амиачный раствор гидрата окиси серебра получают при взаимодействии нитрата серебра с гидроксидом натрия и гидроксидом аммония:
AgNO3+ NaOH → AgOH↓+ NaNO3,
AgOH + 2 NH4 OH→[ Ag(NH3)2] OH + H2O,
аммиачный раствор
серебра
[Ag(NH3)2] OH + 3 H2→ Ag2O + 4 NH4 OH.
Принцип метода. На стенках пробирки с глюкозой образуется зеркало в результате выделения металлического серебра.
Оформление работы: Написать вывод, а также ход и уравнения реакции в тетрадь.
Опыт 2. Реакция Фелинга.
Принцип метода. В пробирке с глюкозой появляется кирпично-красное окрашивание от образующегося оксида меди (I).
По мере нагревания интенсивно-синий цвет реактива Фелинга изменяется. Первоначально появляется жёлтый осадок гидрата закиси меди, который постепенно переходит в закись меди и выпадает на дно пробирки в виде ярко-красного осадка. Находившаяся в растворе глюкоза полностью окисляется до глюконовой кислоты за счёт кислорода гидрата окиси меди.
Схема реакции:
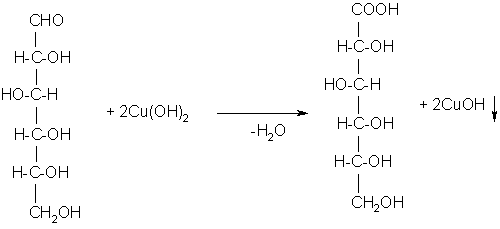
Глюкоза Глюконовая кислота
Реакция взаимодействия глюкозы с реактивом Фелинга
 2
2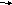 CuOHH2O+Cu2O
CuOHH2O+Cu2O
Порядок выполнения работы.
В две пробирки наливают: а) 2 мл. 1%-ного раствора глюкозы, б) 2 мл. 1%-ного раствора фруктозы. В обе пробирки добавляют по 1 мл реактива Фелинга, представляющего собой щелочной раствор комплексного соединения сульфата меди (II) с виннокислым калий-натрием в 10%-ном р-ре NaOH. Готовят непосредственно перед употреблением. Обе пробирки нагревают до кипения.
Оформление работы: написать вывод, а также ход и уравнения реакции в тетрадь.
Опыт 3. Качественная реакция на фруктозу
Принцип метода. При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты до 80оС через некоторое время в пробирке с фруктозой появляется ярко-красное окрашивание.
При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты появляется вишнево-красное окрашивание. Проба также применима для обнаружения других кетоз. Альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску или вообще не взаимодействуют. Открыта Ф. Ф. Селивановым в 1887 году. Применяется при анализе мочи. Проба положительная при фруктозурии обменного или транспортного генеза. В 13 % случаев проба положительная при пищевой нагрузке фруктами и мёдом. Хим. формула фруктозы – C6H12O6
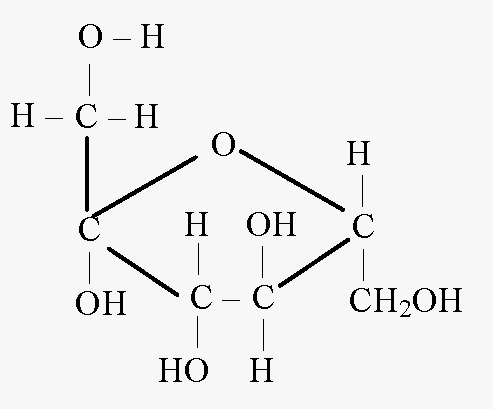
Циклическая формула фруктозы
Ациклическая форма
фруктозы
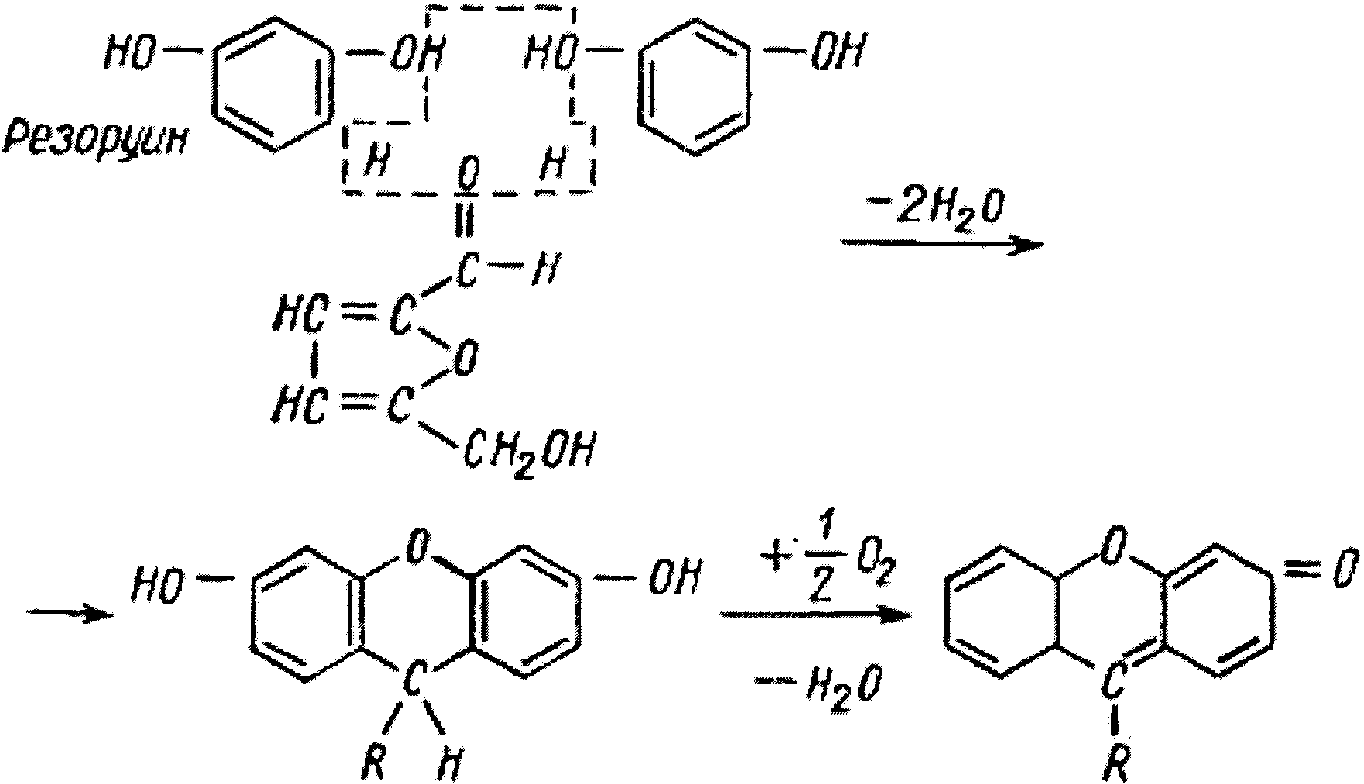
R- осататок Окрашенное соединенue
оксиметилфурфурола
Порядок выполнения работы.
В две пробирки наливают по 2 мл: в одну – 1%-ный раствор глюкозы, в другую – 1%-ный раствор фруктозы. В обе пробирки вносят по 2 мл реактива Селиванова: 0,05 г резорцина растворяют в 100 мл 20 %-ной соляной кислоты. Обе пробирки осторожно нагревают до 80оС (до начала кипения). Появляется красное окрашивание.
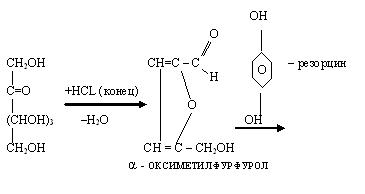
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
Опыт 4. Качественная реакция на молочную кислоту
Принцип метода. Молочная кислота образуется при анаэробном окислении углеводов, появляется в желудочном соке с низким содержанием соляной кислоты или при полном ее отсутствии. Появление молочной кислоты в моче обычно наблюдается после тренировок, включающих упражнения субмаксимальной мощности. Каждое такое упражнение приводит к резкому возрастанию концентрации лактата в крови и последующему его переходу из кровяного русла в мочу. Обнаружить её можно с помощью реактива Уфельмана. Его готовят прибавляя по каплям 1% раствор хлорного железа к 2% раствору фенола до появления фиолетовой окраски. Раствор молочной кислоты (С ₃Н ₆О₃ или СН ₃—СН(ОН)—СООН)в присутствии реактива Уфельмана приобретает желто-зеленую окраску вследствие образования лактата железа.
а) 6C6H5OH + FeCl3 → [Fe(C6H5OH)6]Cl3
фенол хлорное железо образуется трихлоридфенолят железа
(фиолетовое окрашивание)
а) Взаимодействие фенола с хлоридом железа
б) СН3 СН3
3 СНОН + [Fe(C6H5OH)6]Cl3 3 HCl + 6 C6H5OH + 3СНОН
трихлоридфенолят железа фенол
СООН СООFe
лактат лактат железа
(желто-зеленого
цвета)
б)Взаимодействие лактата стрихлоридфенолятом железа
Порядок выполнения работы.
В пробирку наливают 1 мл реактива Уфельмана и добавляют 0,5 мл раствора, содержащего молочную кислоту. Фиксируют изменение окраски.
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
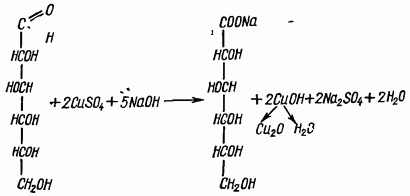
Опыт 5. Реакция Троммера на моносахариды.
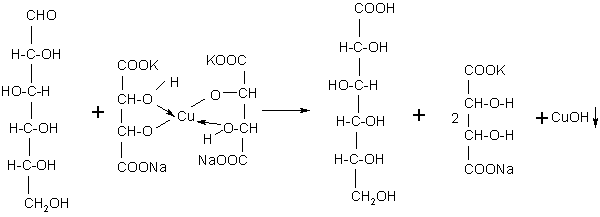
Принцип метода. В щелочной среде альдозы и некоторые дисахариды, имеющие потенциально свободную альдегидную группу или свободный гликозидный гидроксил окисляются до альдоновых кислот, одновременно восстанавливая медь(II) в медь(I). В данной реакции, образовавшийся вследствие взаимодействия NaOH и CuSO4 гидроксид меди(II) [имеет синюю окраску], восстанавливается до гидроксида меди(I) [желтая окраска], который далее распадается до Cu2 O [красная окраска закиси меди].
2NaOH + CuSO4→ Cu(OH)2↓+ Na2SO4
tо
Г люкоза
+ 2Cu(OH)2глюконовая к-та
+ 2CuOH
+ 2H2O
люкоза
+ 2Cu(OH)2глюконовая к-та
+ 2CuOH
+ 2H2O
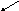
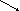
Cu2O↓ H2O
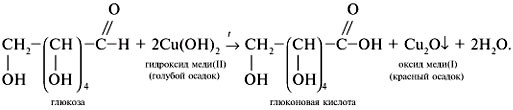
глюкоза глюконовая к-та
Порядок выполнения работы.
В пробирку наливают раствор глюкозы и 6-8 капель 2н NaOH. Затем по каплям добавляют 0,2 н раствор CuSO4 до образования нерастворимого голубого осадка. Осторожно нагревают пробирку на спиртовке. Голубой, не растворимый в воде осадок гидрата окиси меди (II) постепенно переходит в желтый, а затем в красный осадок закиси меди (I). Это указывает на положительную реакцию Троммера.
Избыток медной соли маскирует реакцию, так как гидроокись меди (II) при нагревании теряет воду и дает черный оксид меди (II).
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
Опыт 6. Реакция Барфеда
Принцип метода. Молекулы дисахаридов состоят из остатков двух молекул моносахаридов, соединенных гликозидной связью. К дисахаридам относятся: сахароза (свекловичный или тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар), трегалоза (грибной сахар, микоза), целлобиоза (дисахарид, освобождающийся при гидролитическом расщеплении клетчатки) и др.
По типу связи между молекулами моноз дисахариды можно разделить на две группы: 1) построенные по типу мальтозы; 2) типа трегалозы.
Дисахариды мальтозного типа состоят из двух остатков моноз, соединенных в положении 1,4, т. е. кислородный мостик связывает первый атом углерода одной молекулы моносахарида с четвертым атомом углерода другой.
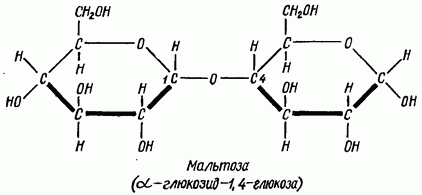
У мальтозы остается свободным один гликозидный гидроксил (карбонильная группа), поэтому дисахариды, построенные по типу мальтозы, сохраняют все реакции, свойственные карбонильной группе (Троммера, Бенедикта, Ниландера, с фелинговой жидкостью и т. д.).
По мальтозному тйпу построены также лактоза и целлобиоза. При гидролизе лактозы освобождаются молекула а-глюкозы и молекула галактозы
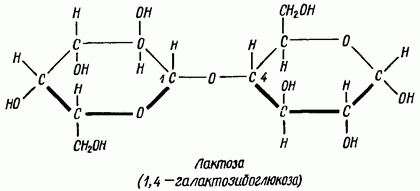
Молекула целлобиозы гидролитически расщепляется на две молекулы -глюкозы. Следовательно, целлобиоза-р-глюкозид-1,4-глюкоза.
В молекулах дисахаридов, построенных по типу трегалозы, моносахариды соединены кислородным мостиком между двумя гликозидными гидроксилами (карбонильными группами). Поэтому дисахариды трегалозного типа лишены восстанавливающих свойств. К дисахаридам указанного типа относятся сахароза и трегалоза. Сахароза легко гидролизуется с образованием смеси равных количеств глюкозы и фруктозы, называемой инвертным сахаром. Инвертный сахар дает все реакции, характерные для моноз.
Реакция Барфеда позволяет быстро отличить моносахариды от дисахаридов мальтозного типа, обладающих, как известно, восстанавливающими свойствами (лактозы, мальтозы, целлобиозы). Она основана на том, что восстанавливающие свойства моносахаридов сохраняются также в кислой среде, тогда как дисахариды восстанавливают металлы только при щелочной реакции. При взаимодействии дисахаридов с реактивом Барфеда красный осадок закиси меди появляется не сразу, а лишь спустя некоторое время (15—20 мин.), когда произойдет их гидролитический распад, который катализируется кислотами.
Порядок выполнения работы.
Отличие восстанавливающих свойств дисахаридов от моносахаридов.
В три пробирки наливают по 1 мл реактива Барфеда (Реактив Барфеда можно готовить и по следующей прописи: в 200 мл горячей воды растворяют 13,3 г уксуснокислой меди. Помешивают до растворения соли, фильтруют. К фильтрату прибавляют 1,9 мл ледяной уксусной кислоты - CH3 COOH.) и прибавляют по 1 мл в одну пробирку глюкозы (7%-ный раствор), в другую – мальтозы, а в третью лактозы (1%-ные растворы дисахаридов). Все пробирки нагревают на водяной бане в течение 10 мин. В пробирке с глюкозой образуется красный осадок оксида меди (I). Дисахариды этой реакции не дают.
Следует избегать длительного кипячения, т.к. дисахариды в кислой среде могут гидролизоваться до моносахаридов, и в результате реакция Барфеда станет положительной. Проба Барфеда отличается от других реакций восстановления тем, что окисление сахара протекает не в щелочной среде (где окисление протекает значительно легче, чем в нейтральной и особенно в кислой), а в среде слабо кислой. В этих условиях дисахариды практически не окисляются, что позволяет их отличить от моносахаридов.
Результат опыта занести в таблицу:
|
№ прбирки |
Варианты опыта |
Используемые реактивы |
Окраска | |
|
Реактив Барфеда |
t°С, время, мин | |||
|
1 |
Глюкоза |
1 мл |
|
|
|
2 |
Лактоза |
1 мл |
|
|
|
3 |
Сахароза |
1 мл |
|
|
Сделать вывод:
Опыт 7. Образование сахарата кальция.
Принцип метода. Наличие спиртовых групп в молекулах сахаров доказывается их способностью давать сложные эфиры, а также сахараты (алкоголяты) при действии гидроксидов щелочных и щелочноземельных металлов. На способности сахарозы образовывать растворимые сахараты кальция основаны методы очистки сахара при его получении из сахарной свеклы.
Порядок выполнения работы.
В стаканчике к 10 мл. 20%-ного раствора сахарозы прибавляют по каплям свежеприготовленное известковое молоко Са(ОН)2, при помешивании стеклянной палочкой. Убеждаются, что в растворе сахарозы гидроксид кальция растворяется. После этого прибавляют еще 5 мл. известкового молока, размешивают стеклянной палочкой и через несколько минут смесь фильтруют. Фильтрат содержит растворимый на холоде сахарат кальция.
[СаОН] + + С12 Н22 О11↔[СаОНС12 Н21 О11] +
щёлочь сахарозакальцийсахарозный комплек
Фильтрат нагревают до кипения – выпадает трехкальциевый сахарат, который при охлаждении снова растворяется, а в растворе остается сахар. Состав этого сахарата отвечает формуле:
С12Н22О11 ∙ 3СаО + 3Н 2 О.
Однако состав сахаратов до сих пор нельзя считать окончательным.
Оформление работы: запишите ход и уравнения реакции в тетрадь.
Опыт 8. Окисление дисахаридов.
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).Связи, соединяющие моносахаридные остатки, называются гликозидными.
Примером наиболее распространенных в природе дисахаридов является сахароза (свекловичный или тростниковый сахар). Молекула сахарозы состоит из остатков глюкозы и фруктозы, соединенных друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2)-гликозидной связью:
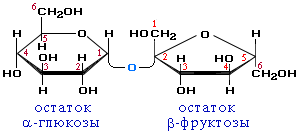
Сахароза
Сахароза, находясь в растворе, не вступает в реакцию "серебряного зеркала", так как не способна превращаться в открытую форму, содержащую альдегидную группу. Подобные дисахариды не способны окисляться (т.е. быть восстановителями) и называются невосстанавливающими сахарами.
Существуют дисахариды, в молекулах которых имеется свободный полуацетальный гидроксил, в водных растворах таких сахаров существуют равновесие между открытой и циклической формами молекул. Эти дисахариды легко окисляются, т.е. являются восстанавливающими, например, мальтоза.
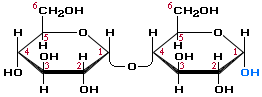
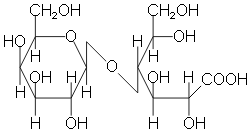
В мальтозе остатки глюкозы соединены (1→ 4)-гликозидной связью.
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды:
![]()
При гидролизе различные дисахариды расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
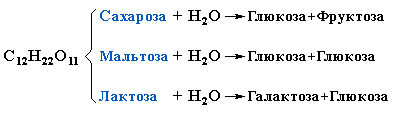
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
Принцип метода. В зависимости от способа связи моносахаридов в молекулах дисахаридов они проявляют разную способность к окислению.
Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга.
Схема реакции окисления мальтозы реактивом Фелинга:
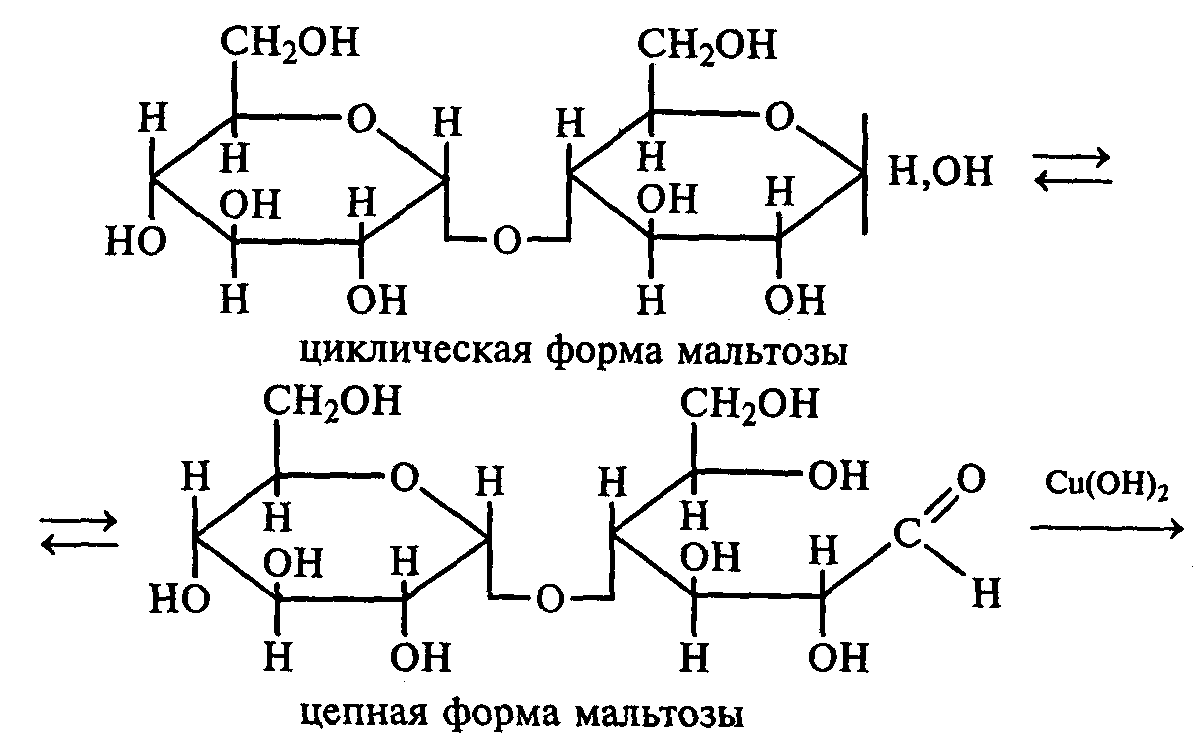
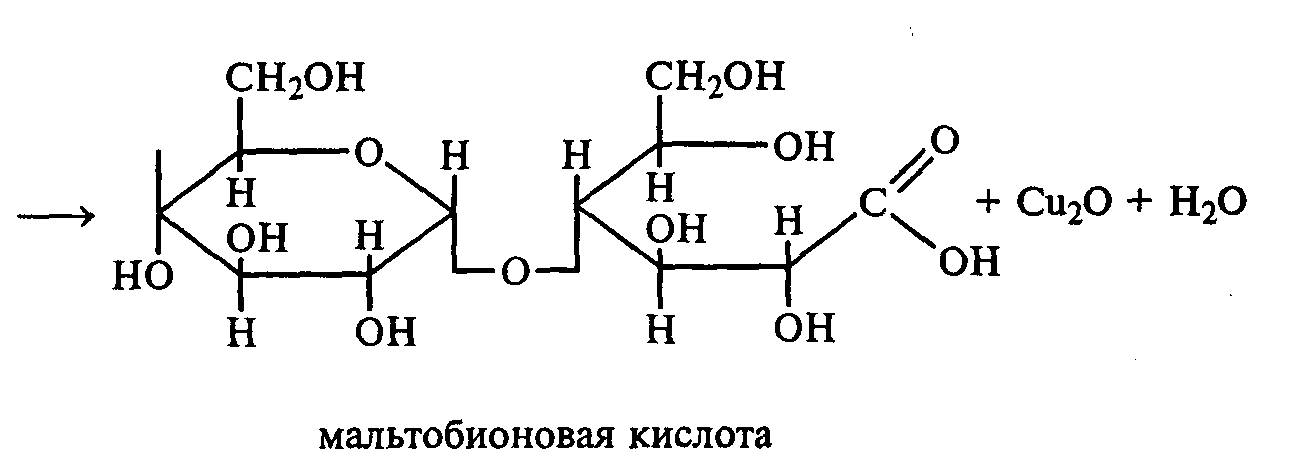
мальтоза реактивом Фелинга
мальтобионовая к-та.
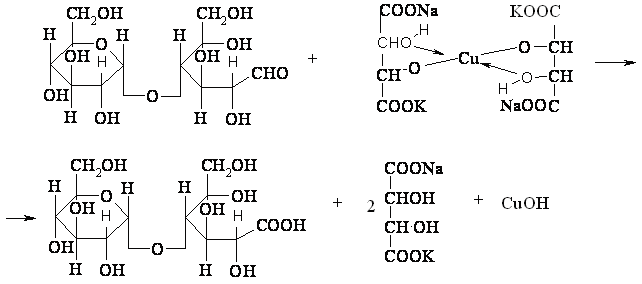
Уравнение реакций окисления лактозы реактивом Фелинга::

COOK NaOOC


 H
H


 C
H O O C H
C
H O O C H



 +
Cu
+
Cu


 C
H O O C H
C
H O O C H

 H
H
COONa KOOC
 COONa
COONa

CHOH

 +
2 + Cu2O
+ H2O
+
2 + Cu2O
+ H2O
CHOH

COOK
лактобионовая к-та.
Порядок выполнения работы.
В 3 пробирки наливают по 2 мл. 1%-ного раствора сахарозы, мальтозы и лактозы. В каждую пробирку добавляют столько же фелинговой жидкости (Реактива Фелинга, представляет собой щелочной раствор комплексного соединения сульфата меди (II) с виннокислым калий-натрием в 10%-ном р-ре NaOH. Готовят непосредственно перед употреблением.). Затем все пробирки нагревают до начинающегося кипения. В пробирке с сахарозой восстановления меди не наблюдается, в двух других появляются осадки оксида меди (I).
Оксид меди, химическое соединение меди и кислорода, существующее в двух формах: закиси (Сu ₂О), блестящий красный порошок, встречающийся в природе в виде минерала куприта, и окиси (СuО), черного цвета.
Оформление работы: объясните различное взаимодействие гидроксида меди (II) с дисахаридами. Составьте уравнения реакции окисления мальтозы и лактозы.
Опыт 9. Кислотный гидролиз сахарозы (инверсия).
Инвертный сахар – сахарный сироп, раствор, состоящий из равных молярных долей глюкозы и фруктозы. Это продукт гидролитического разложения сахарозы на смесь глюкозы и фруктозы, которые привели к изменению направления вращения плоскости поляризации света (инверсии), проходящего через раствор. Инвертный сахар является основным компонентом натурального мёда, в котором образуется под действием фермента инвертазы. Также гидролиз сахарозы происходит в кислой среде.
Используется при изготовлении искусственного мёда, в производстве напитков: джина, виски, пива, игристого вина.
Принцип метода. Все дисахариды способны гидролизоваться с той или иной скоростью при нагревании их в кислом растворе. При этом молекула дисахарида распадается на два моносахарида.
+ H2SO4

Сахароза C12H22O11, или свекловичный сахар, тростниковый сахар, в быту просто сахар – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов – α-глюкозы и β-фруктозы. Сахароза является весьма распространённым в природе дисахаридом. При гидролизе под действием кислот или ферментов сахароза превращается в смесь глюкозы и фруктозы. Это уравнение называется инверсией сахарозы:
С ахароза
+H2O
глюкоза + фруктоза
ахароза
+H2O
глюкоза + фруктоза
Порядок выполнения работы.
В пробирку наливают 2 мл. 1%-ного раствора сахарозы и прибавляют 1 мл. 10%-ной H2SO4, пробирку кипятят 1-2 мин., раствор нейтрализуют сухим бикарбонатом натрия NaHCO3, затем добавляют равный объем фелинговой жидкости и нагревают. (Реактива Фелинга, представляет собой щелочной раствор комплексного соединения сульфата меди (II) с виннокислым калий-натрием в 10%-ном р-ре NaOH. Готовят непосредственно перед употреблением.). При нагревании образуется красный осадок оксида меди (I).
Оформление работы: объяснить механизм гидролиза сахарозы, составьте уравнения: гидролиза сахарозы и взаимодействия глюкозы или фруктозы с реактивом Фелинга.
Опыт 10. Выявление фруктозы в составе сахарозы.
Принцип метода. Сахароза C12H22O11, или свекловичный сахар, тростниковый сахар, в быту просто сахар — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов — α-глюкозы и β-фруктозы. Сахароза является весьма распространённым в природе дисахаридом.
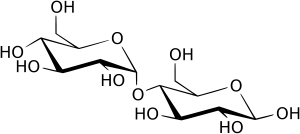
Лактоза– состоит из остатковглюкозыигалактозы.
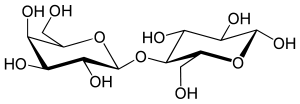
Сахароза– состоит из остатков глюкозы ифруктозы.
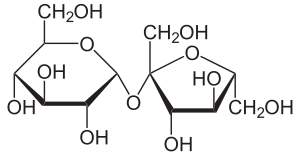
Мальтоза– состоит из двух остатков глюкозы.
Порядок выполнения работы.
В 3 пробирки наливают по 2 мл. 1%-ного раствора сахарозы, мальтозы и лактозы. В каждую пробирку добавляют по 1 мл. реактива Селиванова и все пробирки кипятят. В пробирке с сахарозой появляется красное окрашивание; в двух других – окраска не изменяется.
Оформление работы: объяснить механизм гидролиза исследуемых дисахоридов, составьте уравнения: гидролиза сахарозы и взаимодействия фруктозы с реактивом Селиванова; результаты проделанного опыта записать в тетрадь.
