
- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
Основные положения теории окислительно-восстановительных реакций (овр)
Окисление – процесс отдачи электронов. Вещества (атом, молекула, ион), которые отдают электроны, называются восстановителями. В процессе реакция восстановитель окисляется, а значение степени окисления повышается.
Типичными восстановителями являются:
а) металлы, водород, углерод, СО, H2S, SО2, H2SO3 и соли сернистой кислоты;
б) бескислородные кислоты: HI, НВr, НС1, H2S;
в) соединения азота: HNO2, NH3, N2H4, NO;
г) соли, в которых степень окисления у катионов может возрастать: SnCl2, FeSО4, Cr2(SO4)3;
д) органические соединения: спирты, альдегиды, муравьиная и щавелевая кислоты, глюкоза.
Восстановление – процесс присоединения электронов. Вещества, которые присоединяют электроны, называются окислителями. В процессе ОВР окислитель восстанавливается, значение степени окисления понижается. Типичными окислителями являются:
а) галогены, О2, O3, КМnО4, соли хромовых кислот K2Cr2O7 и; K2CrO4;
б) кислоты: HNO3, Н2SО4 конц, НМnО4, H2CrO4;
в) оксиды металлов: СuO, Ag2O, РbO2, CrO3, MnO2;
г) хлорид железа (III) FeCl3, гипохлориты, хлораты и перхлораты.
В большинстве химических реакций процесс оттока электронов из системы отсутствует, поэтому заряд сохраняется и число электронов, отданных восстановителями, равно числу электронов, полученных окислителями. На этом принципе основаны все методы расстановки коэффициентов в ОВР.
Классификация овр
ОВР делятся на межмолекулярные, внутримолекулярные и реакции диспропорционирования.
Если восстановитель и окислитель содержатся в разных исходных веществах, то ОВР относится к реакциям межмолекулярного окисления – восстановления, например:
![]() .
.
В этой реакции окислитель (Сl+5) и восстановитель (N-3) находятся в разных веществах. Если восстановитель и окислитель содержатся в одном веществе, то ОВР относится к реакциям внутримолекулярного окисления – восстановления, например:
![]() ;
;
![]() .
.
Реакции диспропорционирования можно рассматривать как разновидность реакции внутримолекулярного окисления-восстановления.
Если в исходном веществе атомы элемента находятся в одной степени окисления, а в продуктах реакции – в двух других (более высокой и более низкой по отношению к исходной степени, окисления), то соответствующие ОВР относятся к реакциям диспропорционирования, например:
![]() .
.
Методы расстановки коэффициентов в уравнениях овр
Подбор коэффициентов в ОВР осуществляется в соответствии с правилом: количество электронов, отданных восстановителем, должно быть равно количеству электронов, полученных окислителем. На этом правиле основаны 2 метода расстановки коэффициентов: метод учета изменения степеней окисления (метод электронного баланса) и ионно-электронный метод (метод полуреакций).
1. Расстановка коэффициентов
методом электронного баланса (МЭБ)
Последовательность действий при использовании МЭБ следующая:
выделяем атомы, элементы которых в исходных веществах и продуктах реакции изменяют степень окисления,
составляем электронный баланс присоединения и отдачи электронов, по исходным веществам (для ОВР межмолекулярного гида), или по конечным продуктам (для ОВР внутримолекулярного типа и реакций диспропорционирования);
находим коэффициенты, которые нужно поставить перед формулами веществ, где атомы изменили степень окисления. Для этого сначала находим наименьшее общее кратное для чисел отданных и присоединенных электронов. Соответствующие коэффициенты определяем путем деления наименьшего общего кратного на эти числа;
расставляем найденные коэффициенты сначала перед формулами веществ, в которых атомы изменили степень окисления, а затем перед формулами оставшихся веществ;
проверяем правильность нахождения коэффициентов. Обычно это делают по кислороду.
Рассмотрим примеры расстановки коэффициентов в уравнениях ОВР по МЭБ.
Пример 1. Расставьте коэффициенты в схеме ОВР:
![]()
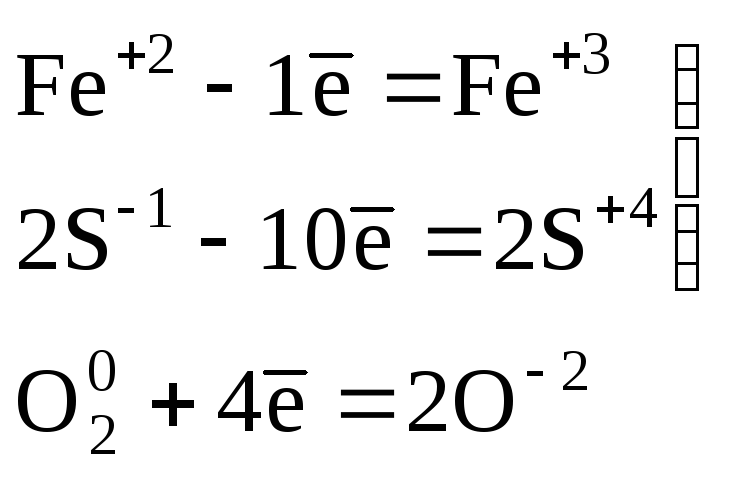
![]()
![]()
![]()
Конечное уравнение этой реакции:
4FeS2
+11О2
![]() 2Fe2O3+8SO2.
2Fe2O3+8SO2.
Пример 2. Расставьте коэффициенты в схеме ОВР:
![]() .
.
Марганец в КМnO4 находится в высшей степени окисления (+7), значит, КМnO4 – окислитель. Продукты его восстановления зависят от кислотности среды, что можно показать схемой:
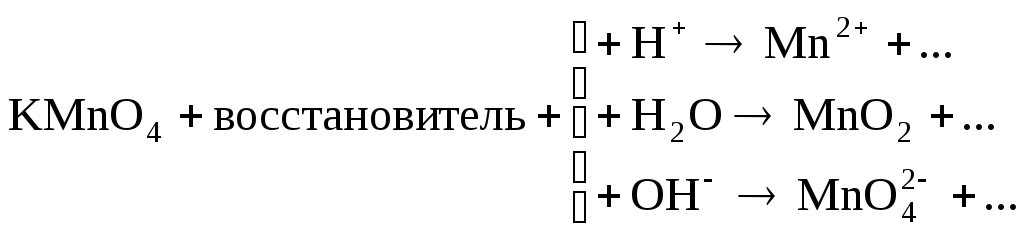 .
.
В данном примере реакция идет в кислой среде, значит, продукт восстановления перманганата калия – ион Мn2+. Восстановителем будет ион Fe2+, который окисляется до Fe3+:
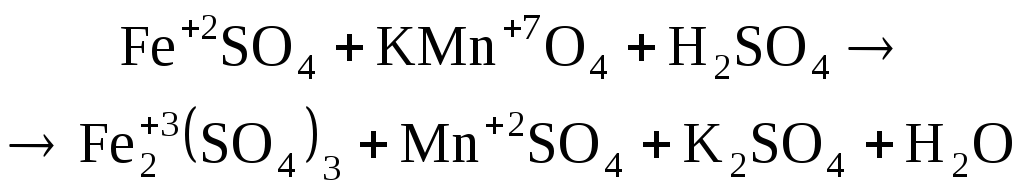
![]()
![]()
![]() .
.
Основными коэффициентами уравнения будут 1 и 5, но в результате реакции образуется соль Fe2(SO4)3, которая содержит два иона Fe (III), поэтому основные коэффициенты нужно удвоить. Подставляем эти коэффициенты сначала в левую, а потом в правую часть схемы реакция, далее подбираем остальные коэффициенты:
![]() .
.
Пример 3. Расставьте коэффициенты в схеме ОВР:
![]() .
.
Данная реакция относится к реакциям внутримолекулярного окисления-восстановления.
Определяем элементы, атомы которых изменили степень окисления. В данном случае это азот и кислород.
Записываем электронные уравнения процессов окисления и восстановления:
![]()
![]()
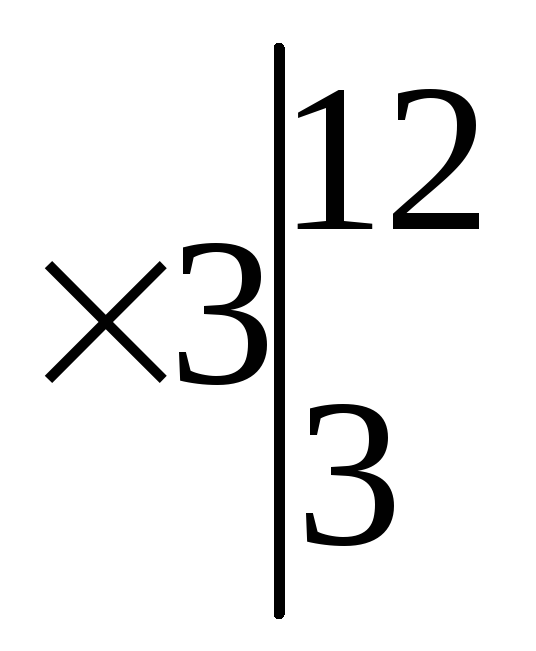
Основными коэффициентами уравнения будут (1) и (4), но вступает в реакцию соль Fe(NО3)3, которая содержит три атома N+5, поэтому основные коэффициенты нужно утроить. Подставляем эти коэффициенты (12) и (3) сначала в левую часть.
Конечное уравнение этой реакции:
![]() .
.
Пример 4. Расставьте коэффициенты в схемах ОВР с участием пероксида водорода.
В молекуле Н2О2 атомы кислорода имеют степень окисления (–1), которая является промежуточной между наиболее характерными для кислорода значениями (–2) и (0). Поэтому пероксид водорода в разных условиях может быть как окислителем, так и восстановителем.
Уравнения соответствующих реакций окисления-восстановления с участием Н2О2 записываем так:
Н2О2-окислитель
![]()
Н2О2-восстановитель
![]()
