
- •Патофизиология как фундаментальная и интегративная наука и учебная дисциплина. Предмет и задачи патофизиологии.
- •Основные этапы развития патофизиологии. Роль отечественных и зарубежных ученых в развитии патофизиологии.
- •Основной метод патофизиологии. Этапы и фазы патофизиологического эксперимента.
- •Способы моделирования патологического процесса. Значение сравнительно-эволюционного метода в изучении патологических процессов и защитно-приспособительных реакций человека.
- •Норма, здоровье, переходные состояния организма между здоровьем и болезнью. Понятие о предболезни.
- •Понятие о патологическом процессе, патологической реакции, патологическом состоянии, типовом патологическом процессе.
- •Болезнетворные факторы внешней и внутренней среды. Значение социальных факторов в сохранении здоровья и возникновении болезней человека. Этиотропный принцип профилактики и терапии болезней.
- •Анализ некоторых концепций общей этиологии (монокаузализм, кондиционализм, конституциализм, психосоматическое направление и фрейдизм в медицине).
- •Алкоголизм, токсикомания, наркомания: характеристика понятий, виды, этиология, патогенез, проявления, последствия.
- •Единство структурных и функциональных изменений в патогенезе заболеваний
- •Причинно-следственные отношения, основное звено и принципы «порочного круга» в патогенезе болезней.
- •Роль специфического и неспецифического в патогенезе заболеваний. Первичные и вторичные повреждения.
- •Защитные, компенсаторные и восстановительные реакции организма. Механизмы выздоровления. Роль нервной и эндокринной систем в механизмах выздоровления. Патогенетические принципы терапии болезней.
- •Исходы болезней. Выздоровление полное и неполное. Ремиссия, рецидив, осложнения.
- •Умирание как стадийный процесс (преагония, агония, клиническая и биологическая смерть).
- •В агональном состоянии:
- •Методы оживления организма. Срочные мероприятия.
- •Хромосомные болезни. Этиология, патогенез.
- •Доминантные, рецессивные и сцепленные с полом наследственные болезни.
- •Основные механизмы развития наследственной патологии связаны с:
- •Гепато-церебральная дистрофия
- •Определение понятия «реактивность». Виды, формы и механизмы реактивности.
- •Резистентность организма к повреждению: пассивная и активная, первичная и вторичная, специфическая и неспецифическая. Взаимосвязь реактивности и резистентности.
- •Определение понятия «конституция организма». Классификация конституциональных типов. Влияние конституции на возникновение и развитие заболеваний.
- •Влияние на реактивность организма возраста, пола, состояния нервной, эндокринной, иммунной и других систем организма, а также факторов внешней среды.
- •Хронобиологические аспекты адаптации. Биоритмы и их роль в формировании патологической реактивности.
- •Иммунитет и его место в патологии. Иммунологическая толерантность. Виды и механизмы формирования.
- •Механизмы формирования иммунологической толерантности:
- •Первичные иммунодефициты
- •Понятие «аллергия». Этиология и общий патогенез аллергических реакций. Принципы патогенетической терапии аллергий.
- •Отличия иммунитета от аллергии. Биологический смысл аллергических реакций. Виды псевдоаллергических реакций, особенности их патогенеза.
- •Особенности патогенеза аллергической реакции реагинового типа.
- •Особенности патогенеза аллергической реакции цитотоксического типа.
- •Особенности патогенеза аллергической реакции иммунокомплексного типа.
- •Причины повреждения
- •Неспецифические изменения клеток при повреждении
- •Механизмы повреждения клеточных мембран и ферментов клетки. Особенности патогенеза свободнорадикального повреждения и гибели клетки.
- •Механизмы гипоксического повреждения и гибели клетки.
- •Последствия нарушений генетического аппарата клетки. Апоптоз, его значение в норме и патологии.
- •Этиология патогенез артериальной гиперемии. Виды, симптомы и значение артериальной гиперемии.
- •Этиология и патогенез ишемии. Виды ишемии. Признаки и последствия ишемии.
- •Венозная гиперемия, ее причины, механизмы развития, признаки. Последствия венозной гиперемии: патологические и защитно-компенсаторные.
- •Причины:
- •Ближайшие последствия:
- •Виды стаза. Причины и механизмы развития стаза.
- •Характеристика понятия «воспаление». Этиология воспаления. Основные компоненты патогенеза воспаления. Роль реактивности в развитии воспаления.
- •Этиология воспаления
- •Биологическое значение экссудации двояко.
- •Виды экссудата:
- •Механизмы краевого стояния и эмиграции лейкоцитов. Роль молекул адгезии и хемоаттрактантов в последовательности эмиграции и хемотаксиса лейкоцитов в очаг воспаления.
- •Виды фагоцитоза, механизмы и стадии фагоцитоза. Причины недостаточности фагоцитоза и их значение при воспалении.
- •Механизмы пролиферации и репарации в очаге воспаления.
- •Патогенетические особенности острого и хронического воспаления. Общие закономерности развития хронического воспаления.
- •Проявления хронического воспаления
- •Определение понятия «лихорадка». Инфекционная и неинфекционная лихорадка. Отличия лихорадки от гипертермии.
- •Виды пирогенов, их источники в организме. Механизмы действия пирогенов.
- •Механизм действия
- •Биологическое значение лихорадки. Понятие о пиротерапии. Принципы жаропонижающей терапии.
- •Этиология и патогенез сахарного диабета. Отдаленные последствия сахарного диабета, механизмы их развития.
- •Механизмы нарушения углеводного и других видов обмена при сахарном диабете.
- •Диабетические комы (кетоацидотическая, гиперосмолярная, лактацидотическая), их патогенетические особенности.
- •Патогенезы:
- •Причины и механизмы нарушения белкового обмена. Положительный и отрицательный азотистый баланс.
- •Причины нарушения белкового обмена:
- •Принципы классификации и основные формы дисгидрий.
- •Патогенетические факторы отеков (пусковые механизмы, основное звено, порочные круги). Защитная и патологическая роль отеков. Принципы патогенетической терапии отеков.
- •Виды общего ожирения. Причины и механизмы развития ожирения.
- •Этиология и патогенез атеросклероза.
- •Основные причины и механизмы нарушения ионного гомеостаза (соотношение натрия, калия, кальция, магния и микроэлементов в жидких средах и клетках организма).
- •Проявления
- •Методы устранения гипомагниемии
- •Понятие «опухолевый рост». Опухолевый атипизм; его виды. Этиология опухолей, общие свойства кацерогенов.
- •Патогенез опухолей. Современные представления о молекулярных механизмах канцерогенеза. Значение онкогенов, роль онкобелков в канцерогенезе.
- •Онкоген
- •Этапы канцерогенеза
- •Отличия злокачественных и доброкачественных опухолей:
- •Биологические особенности, характерные для злокачественных и доброкачественных опухолей:
- •Роль стресс-лимитирующей системы в развитии стресс-реакции.
- •Причины коллапса:
- •Механизмы коллапса:
- •Понятие «шок», критерии шока. Этиология шока. Пути генерализации при шоке. Значение исходного состояния и реактивных свойств организма для исхода шока.
- •Факторы, предрасполагающие к развитию шока:
- •Общий патогенез клеточного этапа развития шока. Критерии необратимых изменений при шоке. Патофизиологические основы терапии шока, коллапса, комы.
- •Причины и механизмы развития нейродистрофии. Влияние нейродистрофии на течение патологического процесса.
- •Типовые формы нейрогенных расстройств движения: параличи, парезы, гиперкинезы.
- •Патофизиология щитовидной и паращитовидных желез.
- •Кретинизм:
- •Патофизиология надпочечников.
- •Расстройства полового развития женского пола:
- •Расстройства полового развития мужского пола:
- •Сердечная недостаточность, ее виды. Этиология и патогенез.
- •Механизмы срочной и долговременной адаптации сердца к перегрузкам. Компенсаторная гиперфункция сердца.
- •Ишемическая болезнь сердца. Причины и механизмы развития. Инфаркт миокарда.
- •П. Нарушения проводимости
- •1) Увеличение числа сердечных сокращений до 90—160 (180) в минуту (укорочение интервалов r—r);
- •Стадии:
- •Причины и механизмы развития вторичных («симптоматических) артериальных гипертензий.
- •Симптоматические артериальные гипертензии
- •Этиология и патогенез постгеморрагических анемий.
- •Проявления
- •Этиология и патогенез гемолитических анемий.
- •Этиология и патогенез железодефицитных анемий. Понятие о сидероахрестических анемиях.
- •Виды эритроцитозов. Причины и механизмы их развития.
- •Виды лейкоцитозов. Причины и механизмы их развития.
- •Виды лейкопений. Причины и механизмы их развития.
- •Анемии. Принципы классификации анемии.
- •Виды лейкозов. Причины и механизмы их развития.
- •По количеству лейкоцитов в периферической крови (в. Демешек; цитируется по а.Ш. Зайчику и а.П. Чурилову, 2002) лейкозы на той или иной стадии течения квалифицируют как:
- •Основные нарушения гематокрита и объема циркулирующей крови.
- •Нарушения осмотической резистентности крови, скорости оседания эритроцитов и вязкости крови.
- •Виды и механизмы развития геморрагических диатезов.
- •Причины и механизмы развития предтромботических состояний. Понятие о тромбофилии.
- •Этиология и патогенез двс-синдрома. Понятие о тромбо-геморрагическом синдроме.
- •Роль лимфатической системы в патогенезе инфекционного процесса (сибирская язва).
- •Понятие «дыхательная недостаточность». Особенности патогенеза острой и хронической дыхательной недостаточности.
- •Патофизиологические формы дыхательной недостаточности. Особенности их патогенеза.
- •Этиология заболевания респираторного дистресс-синдрома
- •Синдромы нарушения кишечного пищеварения. Причины и механизмы их развития.
- •Определение «печеночная недостаточность». Виды. Этиология и патогенез.
- •Нарушения желчеобразования и желчевыделения. Виды и патогенез желтух.
- •Печеночная кома. Этиология. Патогенез.
- •Различают 2 основных вида печеночной комы:
- •При преренальной опн концентрация натрия в моче снижена в сравнении с нормой, а концентрация мочевины, креатинина и осмолярность повышена.
- •1) Инициальную (начальную), 2) олигоанурии, 3)нормализации диуреза и развития полиурии, 4) восстановления (выздоровления).
- •Причины и механизмы развития хронической почечной недостаточности.
- •Причины и механизмы развития нефротического синдрома.
-
Типовые формы нейрогенных расстройств движения: параличи, парезы, гиперкинезы.
Ограничение движений, секреции или других функций носит название парез. Параличом называется полное прекращение движений или других функций.
В зависимости от локализации повреждения различают параличи периферические и центральные.
Периферический паралич возникает после повреждения или полного нарушения целости периферического двигательного нейрона. Экспериментально периферический паралич можно воспроизвести, например, у собаки после перерезки ствола седалищного нерва или отдельных двигательных нервных волокон. Возникает расслабление соответствующей мышцы. Вялый периферический паралич наблюдается также при поражении мотонейронов передних рогов спинного мозга (полиомиелит, ботулизм). При периферическом параличе резко понижается тонус парализованной мышцы, а позднее наступает ее дистрофия и атрофия. Рефлекторная возбудимость парализованной мышцы исчезает, так как дуга рефлекса в двигательной части оказывается нарушенной. Нервная дистрофия парализованной мышцы сопровождается угнетением дыхания ее клеток; увеличивается распад фосфорных макроэргических соединений (АТФ, креатинфосфат), мышца теряет калий. Возбудимость мышцы при нервной дистрофии падает, сократительная способность понижается. При резко выраженной нервной дистрофии мышца на тетанические раздражения отвечает вялыми червеобразными сокращениями. Лишение иннервации существенно меняет отношение мышцы к медиаторам и ядам. Усиливается чувствительность мышцы к ацетилхолину, атропину, пилокарпину и другим холинергическим ядам. Изменяется отношение мышцы к раздражению постоянным электрическим током. Возбудимость на аноде делается больше, чем на катоде, при замыкании раздражающего тока. Это называется реакцией перерождения.
Центральный паралич — нарушение движений вследствие повреждения первого (центрального) нейрона двигательного пути от коры головного мозга до моторного нейрона спинного мозга. В этом случае паралич сопровождается повышением тонуса парализованной мышцы вследствие снятия тормозящих влияний коры на мотонейроны спинного мозга. Произвольные движения в этих условиях невозможны, а рефлекторная деятельность спинного мозга полностью сохраняется и даже усиливается
Различные виды центральных параличей обозначаются следующим образом. Гемиплегия — односторонний центральный паралич верхних и нижних конечностей и лицевого нерва — возникает при поражении (кровоизлиянии) во внутренней капсуле больших полушарий головного мозга, противоположной парализованной стороне. Повреждение в области ножек мозга вызывает гемиплегию с параличом глазодвигательного нерва противоположной стороны. Бульбарная гемиплегия сопровождается анестезией туловища и конечностей на стороне, противоположной параличу. На лице анестезия развивается на парализованной стороне.
Параплегия — паралич обеих рук или ног, возникающий при поражении спинного мозга (травмы, опухоли, кровоизлияния).
Тетраплегия — паралич всех четырех конечностей. Перекрестным параличом называют паралич одной руки и ноги противоположной стороны.
Гиперкинезы — непроизвольные избыточные насильственные движения необычной формы и конфигурации. Они сопровождаются изменениями мышечного
тонуса. Гиперкинезы возникают вследствие повреждений главным образом сложной экстрапирамидной моторной системы, управляющей вместе с мозжечком мышечным тонусом.
гинеркинезов.
Виды гиперкинезов. Различают следующие гиперкинезы:
Дрожание (тремор) — слабые непроизвольные сокращения скелетной мускулатуры вследствие попеременного изменения тонуса мыщц-антагонистов. Во время произвольных движений дрожание при одних болезнях прекращается (эпидемический энцефалит, болезнь Паркинсона), при других (рассеянный склероз), наоборот, усиливается.
Судороги — резкие непроизвольные сокращения мышц с изменениями их тонуса. Различаются судороги клонические и тонические.
Клонические судороги представляют собой быструю смену сокращения и расслабления той или иной группы мышц. Они наблюдаются при эпилепсии, хорее, повреждениях пирамидной системы («клонус стопы», «клонус коленной чашечки»). Заикание — клонические судороги речевой мускулатуры. Тиком называют клонические судороги группы мышц лица.
Тонические судороги представляют собой длительное сокращение мышц с увеличением их напряжения. Они встречаются, например, при столбняке. Клонические судороги нередко сочетаются с тоническими. Это расстройство бывает при эпилепсии и. при так называемом атетозе. Атетоз возникает при поражении полосатого тела и выражается в виде вычурных движений пальцев рук и ног. Одновременно резко повышается тонус сокращающейся мускулатуры. Атетоз резко усиливается при произвольных движениях, волнении.
-
Общая этиология и патогенез эндокринных расстройств.
Центрогенный, первично-железистый и постжелезистый варианты патогенеза.
Центрогенное инициальное звено. Обусловлено нарушением механизмов нейрогуморальной регуляции желёз внутренней секреции со стороны нейронов коры большого мозга и/или гипоталамо-гипофизарной системы. Как правило, является следствием расстройств функций коры головного мозга, гипоталамуса, аденогипофиза, нейрогипофиза.
Причины.
1. На уровне коры большого мозга: дефекты развития и органические повреждения головного мозга (кровоизлияния, рост опухолей); действие токсинов и инфекционных.
2. На уровне гипоталамуса и гипофиза: генные дефекты (мутации генов либеринов, статинов, адено- и нейро-гипофизарных гормонов, а также ферментов синтеза этих БАВ ); прямое повреждение (например, при росте и/или распаде опухоли, кровоизлияниях, сотрясении, сдавлении); воздействие токсичных веществ экзо- и/или эндогенного происхождения инфекционной либо неинфекционной природы (например, этанола, столбнячного токсина, нейротропных ЛС).
Расстройства функций коры головного мозга и гипоталамо-гипофизарной системы приводят к нарушениям образования нейрогормонов гипоталамуса (либеринов, статинов, АДГ), а также тропных гормонов аденогипофиза. Эти нарушения в свою очередь вызывает расстройства функций желёз и клеток внутренней секреции, регулируемых тропными гормонами аденогипофиза.
Первично-железистые расстройства. Вызваны расстройствами синтеза и/или инкреции гормонов эндокринными железами и отдельными эндокринными клеткам.
Постжелезистые эндокринопатии. Обусловлены различными нарушениями транспорта гормона, его рецепции и пострецепторными событиями в клетке-мишени.
Разновидности механизмов:
Транспортный. Заключается в чрезмерном снижении или повышении связывания гормонов с их транспортными белками. В результате уменьшается или возрастает уровень свободного, активного гормона (например, инсулина, кортизола, йодсодержащих гормонов щитовидной железы).
Контргормональный - снижение или устранение эффектов гормонов.
Рецепторный (реактивный) - связан с нарушением взаимодействия гормона с его рецептором.
Метаболический - заключается в нарушениях метаболизма гормонов. Например: асстройства деградации в гепатоцитах инсулина и стероидных гормонов; чрезмерное дейодирование тироксина.
В основе большинства эндокринопатий находится дефицит конкретного гормона. Это определяет один из основных принципов лечения таких заболеваний — заместительную терапию.
-
Патофизиология гипофиза.
Гиперпитуитаризм — избыток содержания и/или эффектов одного либо нескольких гормонов аденогипофиза.
Причины: аденома передней доли гипофиза (реже злокачественных опухолей, патологии гипоталамуса, сопровождающейся гиперпродукцией либеринов и/или гипопродукцией статинов.
Виды:
1. Гипофизарный гигантизм. Макросомия — чрезмерное увеличение роста, размеров тела и внутренних органов — по времени возникновения в онтогенезе является ранней формой эндокринопатии.
Патогенез: центрогенные (поражение нейронов коры и гипоталамуса) – гиперпродукция соматолиберина и СТГ; первично-железистые (гипофизарное, повышение синтеза СТГ), постжелезистые.
Проявления:
- увеличение роста; - несоответствие величины и массы внутренних органов размерам тела; - непропорциональное развитие мышц; - гипергликемия, - гипогенитализм.
2. Акромегалия — диспропорциональное увеличение размера отдельных частей тела (чаще кистей рук, стоп, внутренних органов), сочетающееся с существенными нарушениями жизнедеятельности организма. По времени возникновения в онтогенезе — поздняя форма эндокринопатии. Она развивается после завершения окостенения эпифизарных хрящей. В основе механизмов развития большинства проявлений акромегалии лежит повышение уровня и/или эффектов СТГ.
Патогенез: то же самое, что и гипофизарный гигантизм.
Проявления:
1. Увеличение размеров кистей и стоп за счёт периостального роста костей, стимулируемого СТГ.
2. Огрубление черт лица;
3. Увеличение размеров внутренних органов (сердца, лёгких, печени, почек, селезёнки).
4. Утолщение кожи, уплотнение мягких тканей в связи с разрастанием их соединительнотканных элементов.
5. Расстройства обмена веществ: углеводный – гипергликемия; жировой – повышение уровня холестерина.
6. половые расстройства.
3. Гиперпролактинемия
4. Синдром гипофизарного преждевременного полового развития.
Гипопитуитаризм — недостаточность содержания и/или эффектов одного либо нескольких гормонов аденогипофиза.
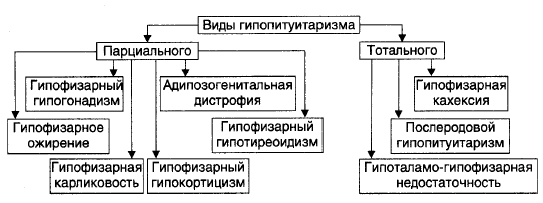
Недостаточность адренокортикотропного гормона. Недостаточное образование АКТГ ведет к вторичной частичной недостаточности коры надпочечников. Страдает в основном глюкокортикоидная функция. Минералокортикоидная функция практически не меняется, так как механизмы ее регуляции иные. Отличием от первичной гипофункции коры
надпочечников является отсутствие развития гиперпигментации, связанное с тем, что уровень АКТГ снижен и его меланофорный эффект не проявляется.
Недостаточность тиреотропного гормона. Снижение образования ТТГ вызывает вторичное снижение функции щитовидной железы, что ведет к развитию симптоматики вторичного гипотиреоза. В отличие от первичной гипофункции щитовидной железы введение ТТГ может восстановить ее функцию. Содержание ТТГ в крови может снижаться и в связи с включением механизма обратной связи при первичной гиперфункции щитовидной железы. Так, например, при диффузном токсическом зобе в связи с гиперфункцией железы и избыточным образованием Т3 и Т4 угнетается образование ТТГ.
Недостаточность гонадотропных гормонов. При недостаточном образовании ГТГ возникают различные расстройства, картина которых зависит от того, какие ГТГ не образуются и насколько их недостаточность сочетается с выпадением секреции других гормонов аденогипофиза. Недостаточное образование у мужчин фолликулостимулирующего гормона (ФСГ) приводит к снижению способности клеток Сертоли накапливать андрогены, что вызывает определенное угнетение сперматогенеза, а это ведет к снижению фертильности у мужчины, т.е. способности к оплодотворению. Во всех других отношениях эти лица здоровы. Клетки Лейдига при этом не страдают и продуцируют андрогены. Угнетение образования лютеинизирующего гормона (ЛГ) (у мужчин он обозначается ГСИК - гормон, стимулирующий интерстициальные клетки) при адекватном образовании ФСГ нарушает функцию клеток Лейдига. Иногда они даже полностью отсутствуют. В результате отсутствует образование андрогенов. Развивается евнухоидизм с сохранением частичной способности к оплодотворению, так как процесс созревания сперматозоидов полностью не прекращается. Одновременное снижение секреции ФСГ и ГСИК приводит к подавлению функциональной активности семенных канальцев и клеток Лейдига. Если этот процесс развивается до наступления полового созревания, появляются евнухоидизм с недоразвитием наружных половых органов и крипторхизм (задержка опущения яичек в мошонку).
Недостаточное образование ГТГ у девочек также приводит к недоразвитию половых органов и вторичных половых признаков.
Секреция ГТГ по механизму обратной связи тормозится половыми гормонами, причем эстрогены являются более мощными ингибиторами, чем андрогены. В физиологических условиях в половых железах мужчин образуется небольшое количество эстрогенов. При патологии это образование эстрогенов может увеличиваться, что приводит к угнетению образования ГТГ и тем самым к развитию гипогонадизма.
При поражении вентромедиальных ядер инфундибулотуберальной части гипоталамуса со вторичным вовлечением гипофиза преимущественно в виде недостаточной секреции ГТГ развивается так называемая адипозо-генитальная дистрофия. Она проявляется в виде гипогенитализма и ожирения с преимущественным отложением жира в области нижней части живота, таза и верхней части бедер. Недостаточная секреция ГТГ вызывает задержку полового созревания.
Гиперфункция передней доли гипофиза
Избыточная секреция соматотропного гормона (гормон роста). Избыточная секреция этого гормона наблюдается чаще всего при эозинофильной аденоме гипофиза.
Клинически это проявляется развитием акромегалии и гигантизма. Акромегалия - заболевание у людей с закончившимся ростом, проявляющееся диспропорциями скелета, мягких тканей (увеличение размеров кистей, стоп, носа, ушей, нижней челюсти), кифосколиозом, спланхномегалией (увеличение размера внутренних органов). Избыточная секреция СТГ в детском возрасте приводит к развитию гигантизма, сопровождающегося увеличением роста более 190 см в сочетании с признаками акромегалии. В 90% случаев развитие акромегалии и гигантизма связано с наличием гормонально-активной эозинофильной аденомы гипофиза. В ряде случаев опухоль не обнаруживается, а развитие гиперплазии гипофиза может быть объяснено, по-видимому, либо избыточной секрецией соматолиберина, либо недостаточной секрецией соматостатина, возникающей в результате
повреждения гипоталамуса. Такими повреждениями могут быть травмы (в том числе родовые), инфекции (вирусные инфекции, скарлатина, сыпной тиф, туберкулез, сифилис), нарушения кровообращения. Увеличенное образование СТГ приводит к нарушению обмена белков, углеводов и жиров.
Нарушения белкового обмена. Усиление роста свидетельствует об активации синтеза белков или торможении их разрушения. Действительно, введение СТГ животным вызывает задержку азота в организме, положительный азотистый баланс и понижение распада белков. При этом установлено увеличение включения разных аминокислот в белки тканей и снижение отношения остаточного азота к белковому.
Считается, что действие СТГ опосредовано действием пептидных ростовых факторов - инсулиноподобных факторов роста (ИФР), синтезируемых в тканях и прежде всего в печени. Именно с их действием связывают такие анаболические эффекты, как:
1) стимуляция включения SO4 в протеогликаны;
2) стимуляция включения тимидина в ДНК;
3) стимуляция синтеза РНК;
4) стимуляция синтеза белка СТГ.
Анаболический эффект СТГ обусловливают два момента:
1. Наличие инсулина. На фоне экспериментального диабета у животных и сахарного диабета у людей СТГ обычно не усиливает синтеза белков. Очевидно, это связано с тем, что инсулин активирует обмен углеводов и стимулирует синтез белка.
2. Концентрация глюкокортикоидов. Малые их дозы способствуют реализации анаболического эффекта СТГ, а большие дозы, наоборот, тормозят анаболический эффект СТГ и задерживают рост, что может быть связано с тем, что кортизол в больших дозах угнетает образование ИФР. У больных с эозинофильной аденомой гипофиза часто усилена продукция глюкокортикоидов. Не исключено, что это один из компенсаторных процессов, направленных на ограничение эффекта избыточных количеств СТГ.
Нарушение углеводного обмена. Это нарушение имеет различную степень выраженности. В своей крайней форме проявляется в виде сахарного диабета. Механизм этих нарушений сложен и включает участие следующих факторов:
а) СТГ активирует выход глюкозы из печени за счет активации секреции глюкагона альфа-клетками островков поджелудочной железы, который усиливает гликогенолиз;
б) в поджелудочной железе СТГ стимулирует продукцию инсулина, что усиливает утилизацию глюкозы тканями, однако на уровне клеток тканей СТГ совместно с глюкокортикоидами выступает как антагонист инсулина, т.е. тормозит поглощение глюкозы. Механизм торможения связан с активацией ингибирующей активности β-липопротеиновой фракции сыворотки крови, которая угнетает гексокиназную реакцию, являющуюся пусковой в углеводном обмене;
в) СТГ активирует инсулиназу печени, расщепляющую инсулин. Конечный результат влияния СТГ на углеводный обмен зависит от всех указанных факторов.
Нарушение жирового обмена. СТГ активирует липолиз в жировой ткани, что ведет к увеличению содержания свободных неэстерифицированных жирных кислот в крови, их накоплению в печени и окислению. Усиление окисления выражается, в частности, в увеличении образования кетоновых тел. Этот катаболический эффект осуществляется в присутствии небольших концентраций глюкокортикоидов. Увеличение их количества тормозит мобилизацию жира и его окисление СТГ.
Избыточная секреция адренокортикотропного гормона. Повышенная секреция АКТГ гипофизом приводит к развитию болезни Иценко-Кушинга, которая проявляется двусторонней гиперплазией надпочечников и повышенной секрецией гормонов коры надпочечников. От болезни Иценко-Кушинга следует отличать синдром Иценко-Кушинга, имеющий аналогичную клиническую картину, но обусловленный гормонально-активной аденомой или аденокарциномой коры надпочечников, а также злокачественными опухолями
вненадпочечниковой локализации, продуцирующими АКТГ-подобные пептиды (например, бронхогенный рак легких).
В 1932 г. Кушинг описал ту же клиническую картину, связав ее с базофильной аденомой гипофиза. В настоящее время вопрос этиологии болезни Иценко-Кушинга все еще не решен. Было установлено, что данное заболевание возникает на фоне развития стресса, нейроинфекций, травм мозга, абортов, родов, полового созревания и чрезмерной физической нагрузки. По-видимому, действие этих факторов опосредуется через центральные нейромедиаторы (ацетилхолин, серотонин, норадреналин и др.), которые, в свою очередь, регулируют секрецию кортиколиберина в гипоталамусе. В патогенезе болезни Иценко-Кушинга может иметь значение невосприимчивость нейронов мозга к ингибирующим влияниям механизма обратной связи, развивающаяся и закрепляющаяся в результате повреждения гипоталамуса и высших отделов ЦНС. Так или иначе продукция кортиколиберина в гипоталамусе увеличивается, что приводит к гиперплазии базофильных клеток гипофиза, вырабатывающих повышенные количества АКТГ. Если причина, вызвавшая повышение продукции кортиколиберина, сохраняется длительно, то гиперплазия превращается в микроаденому, а затем и в аденому.
Избыточно образующийся АКТГ оказывает свое действие двояко: а) через надпочечники и б) вненадпочечниковым путем.
В надпочечниках АКТГ стимулирует пучковую и (в меньшей степени) сетчатую зону, усиливая образование главным образом кортизола и кортикостерона, выражением чего является гиперкортизолизм.
Избыточная секреция глюкокортикоидов, в свою очередь, приводит к развитию гипергликемии, поскольку она угнетает утилизацию глюкозы на периферии и усиливает глюконеогенез. Следствием этого является повышенная секреция инсулина, чувствительность к которому в тканях снижается. Усиливая образование кортизола, АКТГ тем самым увеличивает катаболизм белка. С повышенным распадом белка связано развитие ряда симптомов заболевания, таких, как остеопороз (деградация белковой матрицы кости), мышечная слабость (атрофия мышц), стрии.
Избыток кортизола приводит помимо этого к задержке натрия и воды, а также синергически с катехоламинами кортизол действует на периферические сосуды, что вызывает их спазм. Все это приводит к развитию артериальной гипертонии. Повышенное выведение калия способствует развитию мышечной слабости. Избыток кортизола может быть в некоторой степени причиной развития гирсутизма (избыточного оволосенения) у больных женщин.
Вненадпочечниковое действие АКТГ на некоторые обменные процессы отличается от его действия на эти же процессы через усиление секреции кортизола. Так, АКТГ способен увеличивать активность тирозиназы в меланоцитах, что приводит к гиперпигментации. На жировой обмен АКТГ воздействует следующим образом: добавление его непосредственно к жировой ткани стимулирует ее липолитическую активность и тем самым мобилизацию жира с образованием свободных высших неэстерифицированных жирных кислот. Однако усиливая образование кортизола, АКТГ оказывает следующее влияние: а) тормозит мобилизацию жира; б) активирует глюконеогенез и тем самым способствует образованию жира; в) тормозит действие СТГ, активирующее окисление жира. Очевидно, конечный результат зависит от соотношения надпочечникового и вненадпочечникового действия гормона.
Избыточная секреция тиреотропного гормона. Избыточное образование ТТГ стимулирует функцию щитовидной железы, что приводит к усиленному образованию тиреоидных гормонов, развитию вторичного гипертиреоза и тиреотоксикоза. Кроме того, ТТГ увеличивает содержание кислых мукополисахаридов в коже, мышцах и ретроорбитальной клетчатке как интактных, так и тиреоидэктомированных животных. Причиной данного нарушения могут выступать аденомы из базофильных клеток,
секретирующих тиротропин. Они являются редкой формой опухолей передней доли гипофиза.
Избыточная секреция гонадотропных гормонов. К их числу относятся: а) ФСГ (фоллитропин); б) ЛГ (лютропин), или ГСИК; в) пролактин, или лактотропный гормон. Их секреция тесно связана с функцией гипоталамуса. В гипоталамусе выделяются соответствующие либерины, которые, спускаясь в гипофиз, стимулируют там образование ФСГ и ЛГ (ГСИК). Образование же пролактина при этом тормозится. Повреждение срединного возвышения, как и гипофизэктомия, ведет к уменьшению секреции ГТГ и к атрофии половых желез. Наоборот, повреждение задних образований гипоталамуса вызывает усиление секреции ГТГ и в детском возрасте приводит к преждевременному половому созреванию.
Избыточное образование пролактина отмечено у больных синдромом лактореи - аменореи, возникающим в связи с первичным повреждением гипоталамуса. При этом нередко находят опухоль гипоталамуса или хромофобную аденому гипофиза.
