
Методичка по органической химии Часть 2
.pdf
118
Теория
Пятичленные гетероциклические соединения с одним гетероатомом
O |
N |
S |
|
H |
|
фуран |
пиррол |
тиофен |
Все эти соединения являются ароматическими, так как отвечают критериям
ароматичности:
1)S2 – гибридизованные атомы пиррола, фурана, тиофена образуют плоскийскелет;
2)количество р- электронов удовлетворяет формуле Хюккеля 4n+2=N, где n-целое натуральное число.
4р Электрона поставляют атомы углерода и 2рэлектрона – гетероатомы N, O
или S. Образуется - электронный секстет;
3)6рэлектронов образуют единое сопряженное облако, делокализованное по всему кольцу.
Общей чертой ароматических гетероциклов и производных бензола является высокая термодинамическая устойчивость.
Отличие от бензола.
1)6р Электронов распределяются по пятицентровой системе, поэтому такие системы называются суперароматическими, или -избыточными; их реакции электрофильного замещения идут легче, чем в бензоле.
2)Из-за влияния гетероатома электронная плотность увеличена в -положениях кольца (2 и 5), поэтому атака электрофильного реагента происходит предпочтительно в эти положения.
3)Энергия сопряжения у пятичленных гетероциклических соединений меньше, чем у бензола (22-28 ккал/моль, а у бензола– 36 ккал/моль).
Поэтому легче идут реакции с раскрытием кольца. Например, реакции восстановления.
Электронное строение «пиррольного» атома азота
|
.. |
.. |
|
N |
. . |
|
|
H |
. |
Химические свойства пятичленных гетероциклических соединений на примере пиррола.

119
1.Ароматические свойства. Реакция SЕ протекает легче, в более мягких условиях.
SO2Cl2
N |
Cl |
+ SO2 + HCl |
|
|
|
H |
|
|
-хлорпиррол
N |
|
H |
SO3 |
|
|
|
в пиридине |
 N
N SO3H H
SO3H H
- сульфопиррол
2. Основные свойства почти отсутствуют, так как электронная пара втянута в сопряжение: Коснпиррола=10-14; Косн анилина =10-10. При насильственном протонировании сильными минеральными кислотами ароматическая система нарушается, пиррол превращается в неустойчивый дивиниламин, который быстро полимеризуется с образованием смолы:
Н+ |
|
полимеризация |
|
+ |
смола |
N |
|
|
N |
|
|
H |
|
H H
неустойчивый
дивинилимин Это свойство осмоляться под действием кислот называется «ацидофобностью», и
его надо учитывать при выборе реагентов в реакциях электрофильного замещения (см.
п.1)
3. Кислотные свойства – тоже слабые. Взаимодействие со щелочными металлами идет с образованием неустойчивых солей.
К/t
+ Н2
Н2О
N N
H
K
неустойчивая соль пирролят калия
4. Восстановление (HI, t=30°). Протекает легче из-за меньшей энергии сопряжения по сравнению с бензолом.
2[H] |
|
2[H] |
N |
N |
N |
H |
H |
H |
пиррол |
пирролин |
пирролидин |

120
По мере восстановления основность повышается. Восстановленное пиррольное кольцо входит в состав алкалоидов, аминокислот (пролин, оксипролин). Его производное
– N-винилпирролидон применяется в медицине в качестве заменителя плазмы крови и клеящего, связующего материала.
 O N
O N
CH=CH2
В природных соединениях ароматический пиррольный цикл часто встречается в различных многоядерных системах, из которых особенно важно ароматическое порфириновое ядро, входящее в состав гемоглобина и хлорофилла. Порфирин имеет единое - электронное облако, содержащее 26 - электронов; 22 электрона одиннадцати сопряженных двойных связей и 2 неподеленные пары электронов атома азота. Этот цикл отличается также высокой термодинамической устойчивостью.
Шестичленные гетероциклические системы с одним гетероатомом
Пиридин
|
|
|
|
|
|
|
N |
|
|
|
С точки зрения электронного строения это аналог бензола, а точнее – нитробензола. Азот, как электроноакцептор, стягивает к себе - электронное облако, в целом понижая электронную плотность ароматического кольца.
Такая ароматическая система рассматривается как - недостаточная.
Электронное строение «пиридинового» атома азота
.
. .
..
Химические свойства
1.Ароматические свойства. Пиридин вступает в реакции электрофильного замещения (SE), но из-за -недостаточности легче протекают реакции нуклеофильного замещения (SN).
H2SO4, t=300° SO3H
SE
N
(в 3 или 5 положения)
N
NH3, t=2000 |
NH |
|
N |
SN |
|
|
2 |
(в 2,4,6–положения)
121
2. Основные и нуклеофильные свойства – за счет неподеленной электронной пары пиридинового атома азота. Водный раствор пиридина имеет основную реакцию на индикатор. Косн =1,7. 10-9; Косн анилина = 4 . 10-10.
|
+ |
|
H+Cl- |
Сlˉ |
Соль - |
|
N |
хлористый |
|
пиридиний |
|
|
|
|
|
H |
|
N |
|
|
|
+ |
|
+ |
|
|
CH3-Cl- |
Clˉ |
Соль – |
|
N |
хлористый |
|
CH3 |
метилпиридиний |
|
|
3. Восстановление. В отличие от бензола пиридин восстанавливается водородом в момент выделения (Na + C2H5OH) с образованием пиперидина (Косн = 1,33 . 10-3):
6[Н]
N N H
В катионе пиридиния - недостаточность выражена еще сильнее, вследствие чего он еще легче вступает во взаимодействие с нуклеофильными реагентами, например с гидрид-иоH ном ( )
|
H |
H |
|
|
|
|
H |
|
+ |
- H |
|
NR |
|
NR |
катион |
восстановленный |
|
алкилпиридиния |
алкилпиридиний |
|
В результате этой реакции алкилпиридиний – катион восстанавливается (принимает электронную пару гидрид-иона). При этом кольцо теряет ароматичность, т.е. переходит от термодинамически более устойчивого состояния к менее устойчивому. В результате обратной реакции происходит окисление и возвращение к более устойчивой структуре.
Пиридиновый цикл входит в состав многих лекарственных средств. Наиболее известным из них является производное никотиновой и изоникотиновой кислот:
|
O |
COOH |
C |
|
|
|
NH2 |
N |
N |
|
|
никотиновая кислота |
амид никотиновой кислоты |
витамин РР |
|

122
|
O |
COOH |
C |
|
NH - NH2 |
N |
N |
изоникотиновая |
гидразид |
кислота |
изоникотиновой |
|
кислоты |
Амид никотиновой кислоты (никотинамид) входит также в состав кофермента НАД+, являющегося простетической небелковой группой ферментов дегидрогеназ. НАД+ является одним из наиболее общих окисляющих агентов в природных системах. Функция его как окислителя состоит в отщеплении Нˉ от органических соединений (спиртов, оксикислот и т.д.).
|
|
|
|
O |
|
H |
|
H |
O |
||
|
|
|
|
|
H |
|
|||||
|
|
|
C |
|
|
|
|
|
|
C |
|
|
|
|
|
+ R–CH–OH |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
NH2 |
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
||
N+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
R |
|
|||||
+ R-CHO
+ R-CH-OH
H+
Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы, содержащие атом азота называются азолами. Главные представители:
|
N |
N |
N |
|
|
NH |
NH |
S |
|
||
пиразол |
имидазол |
тиазол |
(1,2-диазол) |
(1,3-диазол) |
|
Старшинство гетероатомов при нумерации: O S NH N.
Химические свойства
1. Ароматические свойства. Их структура отвечает критериям ароматичности. Они вступают в реакции электрофильного замещения (SE) в 4 положение – сказывается ориентирующее действие гетероатомов. В отличие от пиррола они не проявляют ацидофобных свойств. Устойчивы к действию кислот, а также окислителей и щелочей.
|
|
+ |
HNO3 |
H2SO4 O2N |
+ |
Н2О |
||||
|
|
|
||||||||
|
|
|
N |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|||
|
NH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
NH |
|
|
||
пиразол |
|
4 – нитропиразол |
|
|
||||||
2. Основные свойства проявляются за счет «пиридинового» атома азота.

123
: N |
|
|
H+Clˉ HN |
|
+ Сlˉ |
|
|
|
|||
|
|
||||
|
|
|
|
|
|
|
|
|
|
NH |
|
|
NH |
|
|||
|
|
|
|
||
имидазол |
хлористый имидазолий |
||||
3. Восстановление осуществляется водородом в момент выделения:
|
|
2 H |
|
|
|
|
2 H |
|
|
NH |
|
|
N |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
||||
|
NH |
|
NH |
|
NH |
|||||
пиразол |
пиразолин |
пиразолидин |
||||||||
Основность по мере восстановления возрастает, так как увеличивается электронная плотность на основных центрах вследствие ликвидации ароматичности.
Пиразолин легко окисляется. Одним из производных является пиразолон-3.
|
|
|
|
|
|
|
||
|
|
4 |
|
|
|
5 |
|
|
O |
|
3 |
2 |
1N |
H |
|||
|
||||||||
|
|
|
N |
|
|
|
||
|
|
|
|
|
|
|
||
H
На его основе создана целая группа лекарственных препаратов – антипирин, амидопирин, анальгин и др.
|
|
|
|
|
CH3 |
(CH3)2N |
|
|
|
CH3 |
CH2-SO3Na |
||||||
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
CH3 |
|||
O= |
|
|
|
|
|
O= |
|
|
|
|
H3C |
|
|
|
|
|
|
|
N N CH3 |
|
N N CH3 |
|
|
|
|
|
|
||||||||
|
|
O= |
|
N |
N |
CH3 |
|||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
C6H5 |
|
|
|
|
|
|
|||
|
|
C6H5 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
C H |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
6 |
5 |
|
|||
|
|
антипирин |
амидопирин |
анальгин |
|
||||||||||||
Они широко применяются в медицине как жаропонижающие, болеутоляющие и успокаивающие средства.
Шестичленные гетероциклические соединения с двумя гетероатомами
Пиримидин
N
N
Химические свойства. 1. Пиримидин сходен с пиридином, но еще больше, чем пиридин, отличается от бензола. Он проявляет ароматические свойства, но так же, как в пиридине, лучше идут реакции нуклеофильного замещения (SN) – в 2,4 и 6 положения:
|
|
|
|
|
NH2 |
N |
NH2Na |
N |
|
NH2Na |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
-NaH |
H2N |
N |
-NaH |
|
|
N |
H N |
|
||
|
|
N |
|||
|
|
|
|||
|
|
|
|
2 |

124
2.Основные свойства. Пиримидин – более слабое основание, чем пиридин, так как 2 электроотрицательных атома азота взаимно понижают электронную плотность, оттягивая ее каждый на себя. Так, он не дает щелочной реакции в Н2О и дает соли с 1 эквивалентом сильной кислоты.
Производные пиримидина
Особенно важны гидрокси- и аминопроизводные пиримидина – урацил, тимин, цитозин – компоненты нуклеиновых кислот. Для них характерна лактим – лактамная таутомерия:
|
OH |
|
|
|
O |
|
|
|
|
|
|
|
N |
|
|
HN |
|
|
|
|
|
|
|
HO |
N |
|
урацил |
O |
NH |
|
|
||||
|
|
|
|
||
|
OH |
|
|
|
O |
|
N |
CH3 |
|
HN |
CH3 |
|
|
|
|
|
|
HO N |
|
тимин |
O |
NH |
|
|
NH2 |
|
|
|
NH2 |
|
N |
|
|
N |
|
HO |
N |
|
цитозин |
O |
NH |
|
|
|
|||
|
|
|
|
||
лактимная форма |
|
лактамная форма |
|||
Способность к таутомерным превращениям играет большую роль в формировании пространственной структуры нуклеиновых кислот. В лактимной форме оксипроизводные пиримидина проявляют кислотные свойства. Особенно сильные кислотные свойства проявляет 2,4,6–тригидроксипиримидин – барбитуровая кислота:
|
OH |
|
|
O |
|
|
N |
|
HN |
CH2 |
|
HO |
N |
OH |
O |
NH |
O |
|
|
|
|
||
барбитуровая кислота
В качестве снотворных и противосудорожных средств используются 5,5– дизамещенные производные барбитуровой кислоты, барбитураты:
|
O |
|
|
O |
|
|
O |
|||||||||||||
HN |
|
|
|
C2H5 |
HN |
|
|
|
|
|
C2H5 |
HN |
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
C2H5 |
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
C6H5 |
|||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
HO N O |
NaO N O |
HO N O |
||||||||||||||||||
барбитал |
барбитал-натрий |
фенобарбитал |
||||||||||||||||||
(веронал) |
(мединал) |
(люминал) |
||||||||||||||||||

125
Биологическая роль пиримидина: 1) входит в состав витамина В1 (тиамин); 2) входит в структуру пурина; 3) тригидроксипиримидин (барбитуровая кислота) составляет основу лекарственных препаратов – барбитуратов; 4) окси- и аминопроизводные пиримидина входят в состав нуклеиновых кислот.
Полициклические гетероциклы
Индол (бензопиррол)
Это конденсированная полициклическая система, состоящая из бензольного и
пиррольного колец
CH3
N |
N |
|
|
H |
H |
|
|
Индол |
Скатол |
Индол и скатол образуются при гниении белков и имеют неприятный запах. Но чистый индол в большом разбавлении имеет цветочный запах. Он содержится в цветах жасмина и апельсина.
Важным производным индола является 3–оксииндол:
OH |
|
O |
N |
N |
CH2 |
|
||
H |
H |
|
3-оксииндол (-индоксил)
Он содержится в растениях в виде гликозидов и в моче животных и человека в виде индикана (3-оксииндолилсульфат калия), а также является полупродуктом при промышленном синтезе красителя индиго.
3-Индолилуксусная кислота – гетероауксин. Она образуется при разложении белков и является гормоном роста растений.
CH2COOH
N H
3 – Индолилуксусная кислота
Триптофан
Эта незаменимая аминокислота входит в состав большинства белков.
CH2 - CH - COOH
NH2
N H
Химические свойства. Реакции индола и его производных сходны с реакциями пиррола. Индол подобно пирролу обладает слабой основностью и кислотностью. Ацидофобен – осмоляется кислотами. При электрофильном замещении заместитель
126
вступает предпочтительно в положение 3 (в отличие от пиррола). Восстанавливается в 2,3– дигидроиндол, мягкое окисление дает индиго.
Хинолин и изохинолин
ХинолинN |
N |
Изохинолин |
Хинолин и изохинолин подобны пиридину как по физическим, так и по многим химическим свойствам. Они вступают в хорошо известные для бензола и пиридина реакции, модифицированные только присутствием второго кольца в качестве заместителя.
Биологическое значение: 1) входит в состав большой группы алкалоидов, главные из которых относятся к группе хинина – алкалоиды опия (морфин, героин, папаверин); 2) входят в состав противомалярийных препаратов.
Акридин
N
Акридин обладает характерным запахом, вызывает раздражение дыхательных путей, раздражает кожу («acer» – едкий). Акридин флюоресцирует (светится).
Биологическое значение: акридиновое ядро составляет основу некоторых алкалоидов, многие синтетические производные акридина являются ценными лекарственными препаратами (противомалярийные препараты, риванол – антисептик) и красителями.
Пурин Это гетероциклическая конденсированная система, состоящая из пиримидинового
и имидазольного кольца.
N  N
N
NN H
пурин
По свойствам он подобен пиримидину и имидазолу. Для него характерны: 1) ароматические свойства; 2) реакции нуклеофильного замещения (SN) - направляются в 2,6,8-положения; 3) амфотерность, образует соли и с кислотами (за счет «пиридинового» атома азота), и со щелочами (за счет «пиррольного» атома азота); 4) устойчив к действию окислителей; 5) хорошо растворим в воде.
Производные пурина Важными производными пурина являются окси- и аминопроизводные пурина –
компоненты нуклеиновых кислот. Для оксипроизводных пурина, так же как пиримидина, характерны лактим – лактамная таутомерия и миграция атома водорода между положениями 7 и 9 имидазольного кольца.
В состав нуклеиновых кислот входит лактамная форма, как более устойчивая:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
127 |
|||
|
|
|
|
NH2 |
|
|
|
|
OH |
|
|
|
|
O |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
|
|
|
|
N |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
N |
|
|
|
N |
|
N |
|
N |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N N |
H N N N |
|
|
|
H2N N N |
|
|
|
|
|||||||||||||||
|
|
|
|
|
H |
2 |
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аденин |
|
|
|
|
|
|
|
|
|
Гуанин |
|
|
|
|
||||||||||
Важным продуктом азотистого обмена в организме человека и животных является триоксипурин - мочевая кислота.
OH |
|
|
O |
|
|
N |
|
N |
HN |
|
NH |
HO N |
N |
OH |
O N |
N |
O |
|
H |
|
H |
H |
|
Мочевая кислота
Это кристаллическое вещество, плохо растворимое в воде, хорошо – в щелочах. Дает средние и кислые соли – ураты. Средние соли калия, натрия, лития хорошо растворимы в воде. Кислые соли (кроме солей лития) трудно растворимы в воде, особенно ураты аммония. Они входят в состав почечных камней, откладываются в суставах при подагре.
Нуклеиновые кислоты
Нуклеиновые кислоты (ДНК, РНК) играют главную роль в передаче наследственной (генетической) информации и в управлении процессом биосинтеза белка. Это биополимеры, мономерами которых являются мононуклеотиды.
Мононуклеотиды состоят из гетероциклического основания, связанного с углеводным остатком, этерифицированным, в свою очередь, фосфорной кислотой.
Вкачестве гетероциклического основания используются пиримидиновые (урацил, тимин, цитозин) и пуриновые (аденин, гуанин) основания (в лактамной форме).
Вкачестве углеводного компонента – пентозы: D- рибоза и 2-дезокси D – рибоза.
Обе пентозы находятся в -фуранозной форме.
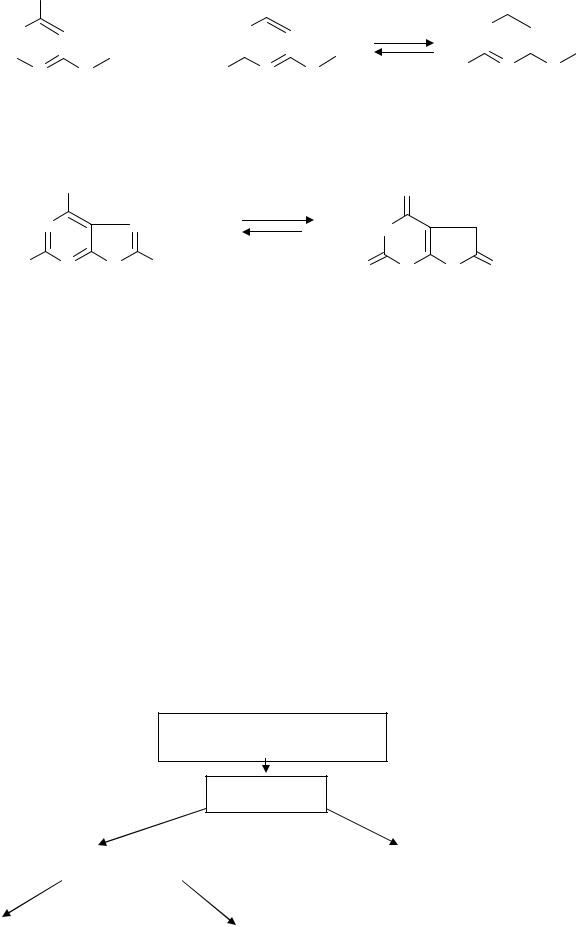
Общая схема построения нуклеиновых кислот
Нуклеиновые кислоты
Нуклеотиды
|
|
H3PO4 |
Нуклеозиды |
|
|
|
|
|
|
|
|
Гетероциклические |
|
Углеводы |
основания |
|
|
|
|
|
